题目内容
【题目】(一)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
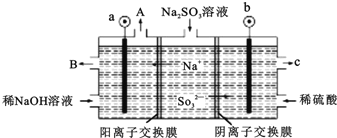
(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式___。
(2)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(3)SO32放电的电极反应式为___。
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___。
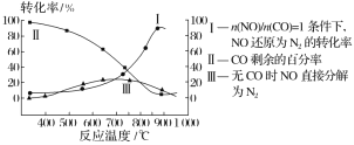
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO
【答案】2NaOH+SO2=Na2SO3+H2O 负 硫酸(H2SO4) SO322e+H2O=SO42+2H+ 在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2OH++OH正向移动,所以碱性增强 B
【解析】
(一)(1)过量的NaOH溶液吸收烟气中的SO2生成正盐亚硫酸钠和水;
(2)依据电解质溶液中阴阳离子的移动方向判断电极,阳离子移向阴极,可以判断图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4;
(3)亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子;
(4)依据阴极区放电离子为氢离子,结合水的电离平衡H2OH++OH-解答;
(二)A. 该反应为反应前后气体体积不变的可逆反应,在反应过程中,气体的总物质的量始终不变,又因为容器恒容,所以容器内压强始终不变,据此分析;
B. 该反应中NO2为红棕色气体,在恒容容器中混合气体颜色保持不变,说明NO2的浓度已不再变化,据此分析;
C. 将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生反应,SO3与NO以1:1生成,所以在反应过程中及平衡状态SO3与NO体积比总是1:1,据此分析;
D. 不同物质的正逆反应速率比等于方程式中系数比时,才能说明平衡状态;不同物质的同向速率比等于方程式中系数比时不能说明平衡状态,据此分析。
(一)(1)过量的NaOH溶液吸收烟气中的SO2生成正盐亚硫酸钠和水,化学方程式为:2NaOH+SO2=Na2SO3+H2O;
故答案为:2NaOH+SO2=Na2SO3+H2O;
(2)由图可知,钠离子移向a极,亚硫酸根离子移向b极,所以a极为阴极,应该接电源的负极,SO32在阳极失去电子变成SO42,所以C口流出的物质是H2SO4;
故答案为:负;硫酸(H2SO4);
(3)亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO322e+H2O=SO42+2H+;
故答案为:SO322e+H2O=SO42+2H+;
(4)在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2OH++OH正向移动,所以碱性增强;
故答案为:在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2OH++OH正向移动,所以碱性增强。
(二)A. 该反应为反应前后气体体积不变的可逆反应,在反应过程中,气体的总物质的量始终不变,又因为容器恒容,所以容器内压强始终不变,所以体系压强保持不变,不能说明反应达到了化学平衡状态,故A错误;
B. 该反应中NO2为红棕色气体,在恒容容器中混合气体颜色保持不变,说明NO2的浓度已不再变化,则NO2的正逆反应速率相等,即化学反应达到了平衡状态,故B正确;
C. 将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生反应,SO3与NO以1:1体积比生成,所以在反应过程中和平衡状态时SO3与NO体积比总是1:1,因此SO3与NO的体积比保持不变,不能说明化学反应达到了平衡状态,故C错误;
D. 不同物质的正逆反应速率比等于方程式中系数比时,才能说明平衡状态;不同物质的同向速率比等于方程式中系数比时,不能说明平衡状态;该选项中每消耗1molSO2的同时生成1molNO,即SO2和NO的正反应速率比等于方程式中系数比(同向速率)不能说明化学反应达到了平衡状态,故D错误;
答案选B。

 名校课堂系列答案
名校课堂系列答案