题目内容
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。

(1)脱硝反应机理如图,Cu+的作用是___,C2H4参与的反应方程式__。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH=-1627kJmol-1
4N2(g)+6H2O(g);ΔH=-1627kJmol-1
①该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是__。
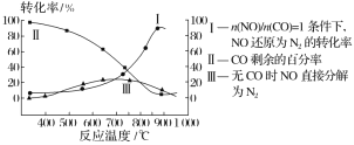
②氨氮比n(NH3)/n(NO)![]() 会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是___。
>1.0时,烟气中NO含量反而增大,主要原因是___。

(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是___;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是___。

【答案】催化剂 2C2H4+6Cu+(NO2)=3N2+4CO2+4H2O+6Cu+ 正反应放热,温度过高会降低NO的转化率 NH3和O2再次反应生成NO(或4NH3+5O2=4NO+6H2O) pH<7时,随着pH值的增大,ClO2的稳定性降低氧化性减弱,SO2的脱除率降低 当pH>7.8后,随着碱性的增强,生成ClO2-增多,氧化性增强,SO2的脱除率上升
【解析】
(1)根据图象可知,Cu+在反应前后不变,乙烯与O2、NO在Cu+作用下生成CO2、N2和H2O,以此分析作答;
(2)①根据温度对反应速率和化学平衡的影响进行分析;
②NH3与O2反应生成NO;
(3)根据题意可知ClO2在酸性条件下稳定,酸性减弱,ClO2氧化性减弱;随着pH的增大,ClO2在碱性条件下可发生歧化反应生成亚氯酸盐,亚氯酸盐具有强氧化性。
(1)根据图象可知,Cu+在反应前后不变,乙烯与O2、NO在Cu+作用下生成CO2、N2和H2O,反应方程式为:2C2H4+6Cu+(NO2)=3N2+4CO2+4H2O+6Cu+;
(2)①该反应为放热反应,温度过高,使脱硝的主要反应平衡逆向移动,脱硝率降低;
②当![]() >1.0时,过量的NH3与O2反应生成NO,所以烟气中NO的浓度增大,烟气中NO的含量增大;
>1.0时,过量的NH3与O2反应生成NO,所以烟气中NO的浓度增大,烟气中NO的含量增大;
(3)根据题意可知ClO2在酸性条件下稳定,具有强氧化性,因此当3<pH<7时,随pH的增大,SO2脱除率逐渐降低;在pH>7.8时,随pH的增大,ClO2在碱性条件下可发生歧化反应生成亚氯酸盐,亚氯酸盐具有强氧化性,SO2脱除率又开始升高。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案