题目内容
【题目】配平下列氧化还原反应方程式:
(1)______![]() ______HCl—______
______HCl—______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______H2O
______H2O
【答案】2 16 2 2 8 5 2 5 6H+ 2 5 8
【解析】
(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;
(2)反应中MnO4-→Mn2+,Mn元素化合价由+7降低为+2,共降低5价,H2O2→O2,O元素化合价由-1升高为0价,共升高2×1=2价,然后用最小公倍数方法配平参加氧化还原反应的元素,再根据电荷守恒确定缺少的项的微粒及数目,最后配平未参加氧化还原反应的元素。
(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4、MnCl2的系数为2,Cl2的系数为5,HCl的系数是10,再根据K守恒,可知KCl系数是2,由于反应后有6个-1价的Cl,化合价反应前后不变,则反应的HCl的系数应该由10改为10+6=16,根据H守恒,可知H2O的系数为8,所以配平后的方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑,则配平后相应物质的系数由前到后依次为2、16、2、2、8、5;
(2)反应中物质的化合价变化MnO4-→Mn2+,Mn元素化合价由+7价→+2价,共降低5价,H2O2→O2,O元素化合价由-1升高为0价,共升高2×1=2价,元素化合价升降最小公倍数为10,故MnO4-、Mn2+的计量数为2,H2O2、O2的计量数为5,根据电荷守恒,可知缺项微粒为H+,系数是6,然后根据原子守恒配平H2O的系数是8,所以反应方程式为:2MnO4-+5H2O2+6H+=2Mn2++ 5O2↑+8H2O。故方程式由前到后依次为2、5、6H+、2、5、8。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
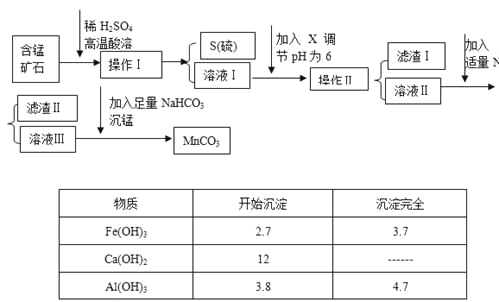
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。