题目内容
8.三硅酸镁(MgSi3O8•nH2O)在医药上用于治抗酸药,能中和胃酸和保护溃疡面.某工厂用SiO2、MgSO4为原料制备Mg2Si3O8•nH2O,其流程如甲图: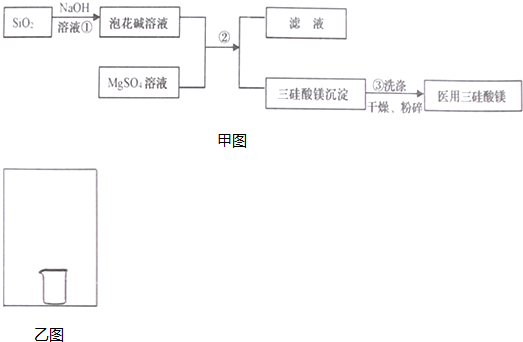
(1)由步骤①可知泡花碱溶液的溶质是Na2SiO3(填化学式),将直径为1~100nm之间的SiO2颗粒分散到丙酮中形成的分散系类型是胶体.
(2)工业上制备的MgSO4溶液中常含有Mn2+,请写出NaClO溶液将Mn2+氧化为MnO2的离子方程式ClO-+Mn2++2OH-=Cl-+MnO2↓+H2O.
(3)步骤②反应后进行了过滤操作,请在乙图中补画出过滤时使用的玻璃仪器;步骤③中确定Mg2Si3O8•nH2O沉淀已洗涤干净的方法取最后一次洗涤液滴加适量BaCl2溶液,若无白色沉淀生成,则说明已洗净.
(4)将0.184g三硅酸镁加到50.00mL 0.1000mol•L-1盐酸中,充分反应后,滤去沉淀,用0.1000mol•L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30.00ml,则Mg2Si3O8•nH2O中n值为6;若在滴定结束时仰视读数,则n值偏高(填“偏高”或“偏低”).
分析 SiO2与NaOH反应生成Na2SiO3,硅酸钠与硫酸镁反应得到三硅酸镁沉淀与硫酸钠溶液,过滤分离,
(1)SiO2与NaOH反应生成Na2SiO3;直径为1~100nm的SiO2颗粒分散到丙酮中形成胶体;
(2)NaClO溶液将Mn2+氧化为MnO2,还原得到氯离子,NaClO溶液呈碱性,反应还生成水;
(3)过滤操作需要用到玻璃仪器有:烧杯、漏斗、玻璃棒,注意过滤中“一贴二低三靠”;Mg2Si3O8•nH2O沉淀表面会附着硫酸钠,用BaCl2溶液检验最后一次洗涤液是否含有SO42-,判断沉淀洗是否涤干净;
(4)三硅酸镁与HCl反应的化学方程式为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,剩余的盐酸用NaOH溶液滴定,消耗30.00mL氢氧化钠溶液,则与三硅酸镁反应的HCl为0.050L×0.1mol/L-0.030L×0.1mol/L,根据方程式计算0.184gMgSi3O8•nH2O的物质的量,进而计算n的值;
若在滴定结束时仰视读数,V(NaOH)读数偏大,测定剩余的盐酸偏大,则与三硅酸镁反应的盐酸偏小,故测定MgSi3O8•nH2O的物质的量偏小.
解答 解:(1)SiO2与NaOH反应生成Na2SiO3,则泡花碱溶液的溶质为Na2SiO3;将直径为1~100nm的SiO2颗粒分散到丙酮中形成胶体;
故答案为:Na2SiO3;胶体;
(2)NaClO溶液将Mn2+氧化为MnO2,还原得到氯离子,NaClO溶液呈碱性,反应还生成水,离子方程式为:ClO-+Mn2++2OH-=Cl-+MnO2↓+H2O;
故答案为:ClO-+Mn2++2OH-=Cl-+MnO2↓+H2O;
(3)过滤操作需要用到玻璃仪器有:烧杯、漏斗、玻璃棒及铁架台,过滤操作装置图为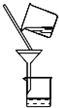 ;
;
Mg2Si3O8•nH2O沉淀表面会附着硫酸钠,取最后一次洗涤液滴加适量BaCl2溶液,若无白色沉淀生成,则说明已洗净,
故答案为: ;取最后一次洗涤液滴加适量BaCl2溶液,若无白色沉淀生成,则说明已洗净;
;取最后一次洗涤液滴加适量BaCl2溶液,若无白色沉淀生成,则说明已洗净;
(4)三硅酸镁中和HCl反应的化学方程式为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,设0.184gMgSi3O8•nH2O的物质的量是x,则:
MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O
1 4
x 0.050L×0.1mol/L-0.030L×0.1mol/L
解得x=0.0005mol,
则0.0005mol×(260+18n)g/mol=0.184g,解得n=6;
若在滴定结束时仰视读数,V(NaOH)读数偏大,测定剩余的盐酸偏大,则与三硅酸镁反应的盐酸偏小,故测定MgSi3O8•nH2O的物质的量偏小,则n值偏高,
故答案为:6;偏高.
点评 本题考查物质制备实验,涉及离子方程式书写、过滤、洗涤、化学式组成的测定等,注意能画出中学常见仪器与装置,要求学生具有分析和解决问题的能力,难度中等.

| A. | 11.2 LNH3中所含的质子数为5NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA 个 |
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
| A. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| B. | 用大理石与稀盐酸制备二氧化碳:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| C. | 用氢氧化钠溶液吸收氯气:Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO${\;}_{3}^{-}$=Cu2++2NO2↑+2H2O |
 .
. .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子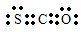 .
.
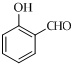 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2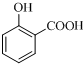 ;
;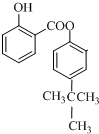 ;
; 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
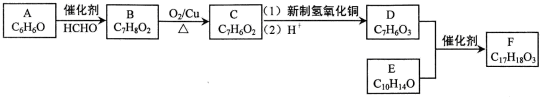
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl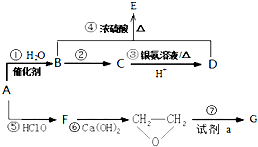 有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示:
有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示: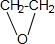 +CaCl2+2H2O.
+CaCl2+2H2O.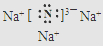 .
.