题目内容
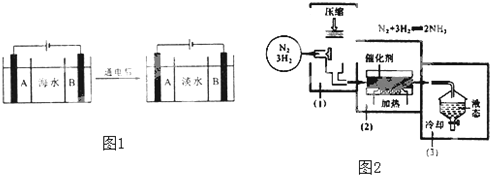
【题目】25℃时,氢氟酸电离常数Ka=6.8×10-4mol·L-1,醋酸电离常数Ka=1.8×10-5mol·L-1。如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系。则Y可以表示( )

A.溶液的pHB.水解平衡常数
C.水解百分率D.溶液中阴离子浓度之和
【答案】A
【解析】
25℃时,氢氟酸的电离常数大于醋酸的电离平衡常数,可知氢氟酸的酸性大于醋酸,氟化钠的水解程度小于醋酸钠.
A.等物质的量浓度的氟化钠和醋酸钠溶液水解呈碱性,随着盐浓度的增大,溶液碱性越强,由于氟化钠的水解程度小于醋酸钠,醋酸钠溶液的碱性更强,pH更大,与图象相符,故A正确;
B.水解平衡常数只受到温度的影响,不受盐溶液浓度的大小影响,与图象不符,故B错误;
C.随着盐溶液浓度的增大,水解程度越来越小,与图象不符,故C错误;
D.根据电荷守恒可知溶液中阴离子浓度之和等于钠离子浓度和氢离子浓度之和,等物质的量浓度的氟化钠和醋酸钠溶液相比,钠离子浓度相等,由于醋酸钠溶液水解程度大,则醋酸钠溶液中氢离子浓度小,因此醋酸钠溶液中阴离子浓度之和比氟化钠溶液中的小,与图象不符,故D错误;
故选:A。

 名校通行证有效作业系列答案
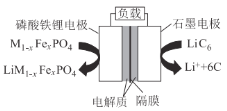
名校通行证有效作业系列答案【题目】合成氨工业中的原料气制取与净化是重要的环节。
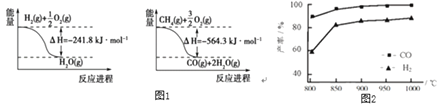
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压