题目内容
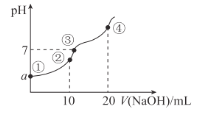
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFePO4 + e- + Li+ = LiM1-xFexPO4 ,其原理如图所示,下列说法正确的是( )
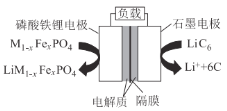
A.电池总反应为 M1-xFexPO4 + LiC6 = LiM1-xFexPO4 + 6C
B.放电时,负极LiC6 中碳元素失去电子变为单质
C.放电时,电流由石墨电极流向磷酸铁锂电极
D.充电时,Li+移向磷酸铁锂电极
【答案】A
【解析】
A.磷酸铁锂电池是以磷酸铁锂为正极材料,正极反应式为:M1-xFePO4 + e- + Li+ =
LiM1-xFexPO4 ,则石墨电极为负极,负极反应式为:LiC6 - e- = Li++ 6C,故电池总反应为: M1-xFexPO4 + LiC6 = LiM1-xFexPO4 + 6C,A正确;
B.放电时,负极LiC6 中锂元素失去电子,B错误;
C.放电时,电流由正极流向负极,即放电时,电流由磷酸铁锂电极流向石墨电极,C错误;
D.充电时,磷酸铁锂电极为阳极,石墨电极为阴极,故充电时,Li+移向石墨电极,D错误;
答案选A。

【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的__________________区;溴的价电子排布式为______________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是____________________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____________________(写出 名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 a、b 所示:
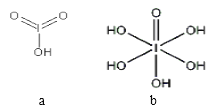
请比较二者酸性强弱:HIO3______________________H5IO6(填“>”、 “<”或“=”)。
(5)已知 ClO2-为 V 形,中心氯原子周围有四对价层电子。 ClO2-中心氯原子的杂化轨道类型为___________________,写 出一个 ClO2-的等电子体______________________。
(6)如图为碘晶体晶胞结构。有关说法中正确的是______________________。
A.碘分子的排列有 2 种不同的取向,2 种取向不同的碘分子 以 4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体中微粒(碘分子)的堆积为最密堆积
D.碘晶体中存在的相互作用有非极性键和范德华力
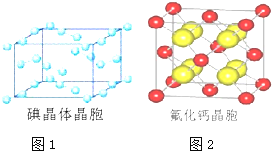
(7)已知 CaF2 晶体(见图)的密度为ρg/cm3,NA 为阿伏加德罗常数,棱上相邻的两个 Ca2+ 的核间距为 a cm, 则 CaF2 的相对分子质量可以表示为__________________。