题目内容
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
⑴过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
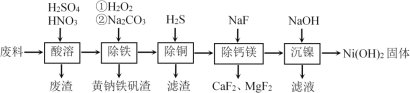
用如下制取装置制备过氧化钙晶体。

①装置A中发生反应的化学方程式为______。
②仪器X的名称为______;Y是______。
③为提高CaO2·8H2O产率,装置B的温度需控制在0℃,可采取的方法是______。
⑵测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.5000 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液体枳为20.00 mL。求产品中CaO2·8H2O的质量分数。(写出计算过程)_____________
已知:CaO2·8H2O+2KI+2H2SO4=CaSO4+2K2SO4+I2+10H2O
I2+2S2O32-=2I-+ S4O62-
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 分液漏斗 稀硫酸 将装置B置于冰水浴中 n(Na2S2O3)=0.200 mol·L-1×20.00 mL×10﹣3=0.004 mol,由关系式“CaO2·8H2O~I2~2S2O32-”可知,n(CaO2·8H2O)= 0.5×0.004mol=0.002 mol,m(CaO2·8H2O)=0.002mol×216g·mol-1=0.432 g,则样品中CaO2·8H2O的质量分数为:ω(CaO2·8H2O)=
CaCl2+2NH3↑+2H2O 分液漏斗 稀硫酸 将装置B置于冰水浴中 n(Na2S2O3)=0.200 mol·L-1×20.00 mL×10﹣3=0.004 mol,由关系式“CaO2·8H2O~I2~2S2O32-”可知,n(CaO2·8H2O)= 0.5×0.004mol=0.002 mol,m(CaO2·8H2O)=0.002mol×216g·mol-1=0.432 g,则样品中CaO2·8H2O的质量分数为:ω(CaO2·8H2O)= ![]() =86.4%。
=86.4%。
![]()
【解析】
根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,据此书写化学方程式;根据仪器的结构和性能确定仪器X的名称;利用反应Ca2++H2O2+2NH3+8H2O═CaO28H2O↓+2NH4+,在碱性环境下制取CaO2,常用冰水浴控制温度在0℃左右,其可能的原因为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率,该反应是放热反应,温度低有利于提高CaO28H2O产率;根据反应的离子方程式:CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式“CaO2·8H2O~I2~2S2O32-”,并以此进行计算。
(1)①根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②仪器X为分液漏斗,Y是稀硫酸,用于吸收挥发出来的氨气;故答案为:分液漏斗;稀硫酸;
③装置B的温度需控制在0℃,可采取的方法是将装置B置于冰水浴中,故答案为:将装置B置于冰水浴中;
(2)根据反应的离子方程式:CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式CaO2~2S2O32-,n(Na2S2O3)=0.200 mol·L-1×20.00 mL×10﹣3=0.004 mol,由关系式“CaO2·8H2O~I2~2S2O32-”可知,n(CaO2·8H2O)=0.5×0.004mol=0.002 mol,m(CaO2·8H2O)=0.002mol×216g·mol-1=0.432 g,则样品中CaO2·8H2O的质量分数为:ω(CaO2·8H2O)= ![]() =86.4%。
=86.4%。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案