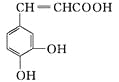
题目内容
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:________________;某学习小组为了测定电解后所得溶液NaOH的浓度,设计了如下实验操作步骤:
①取电解后的溶液10.00mL,加水稀释至100mL;
②量取20.00mL于洁净的锥形瓶,滴加2~3滴酚酞试剂;
③用浓度为0.1010mo/L的标准HCl滴定至终点并记录滴定管的读数为25.00mL
请回答有关问题
①步骤①可能用到的仪器除移液管外,还有_______________
②滴定终点的现象是____________,此溶液中c(Na+)______c(Cl-)(填“<”、“>”或“=”)
③下列操作可能导致所得浓度偏大的是______________
a. 锥形瓶用待测溶液润洗 b.碱式滴定管用待测液润洗
c. 滴定管滴定前有气泡,滴定后无气泡 d. 滴定终点俯视读数
④该实验设计存在的明显不足的是____________
(2)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
①室温下,0.1 mol·L–1 NaClO溶液的pH_____ 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:_____
(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

电解时发生反应的化学方程式为_______________________,溶液X的溶质主要是__________
【答案】2Cl- +2H2O![]() 2OH- +H2↑+Cl2↑ 100mL容量瓶、玻璃棒、胶头滴管 滴加最后一滴溶液,锥形瓶溶液由红色变为无色,并30s保持不变 > ac 未进行平行实验 大于 测得溶液pH<7 NH4Cl +2HCl
2OH- +H2↑+Cl2↑ 100mL容量瓶、玻璃棒、胶头滴管 滴加最后一滴溶液,锥形瓶溶液由红色变为无色,并30s保持不变 > ac 未进行平行实验 大于 测得溶液pH<7 NH4Cl +2HCl![]() NCl3 +3H2↑ NaCl和NaOH
NCl3 +3H2↑ NaCl和NaOH
【解析】
(1)电解精制饱和食盐水生成氯气、氢气、烧碱;
①依据配制一定物质的量浓度的溶液需要的仪器分析;
②酚酞的变色的PH范围是8.2~10.0;
③根据根据c(待测)=![]() 来分析;
来分析;
(2)①酸的电离平衡常数越大,则其相对应的酸根离子水解程度越小,相同浓度的钠盐溶液pH越小.
②依据测溶液pH值方法确定;
(3)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl +2HCl![]() NCl3 +3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-,
NCl3 +3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-,
①由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl +2HCl![]() NCl3 +3H2↑;
NCl3 +3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;
(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl- +2H2O![]() 2OH- +H2↑+Cl2↑
2OH- +H2↑+Cl2↑
故答案为:2Cl- +2H2O![]() 2OH- +H2↑+Cl2↑ ;
2OH- +H2↑+Cl2↑ ;
配制100mL溶液需要100mL的容量瓶,玻璃棒,胶头滴管,
故答案为:100mL容量瓶、玻璃棒、胶头滴管
强酸滴定强碱完全中和时溶液显中性,滴加酚酞后溶液有红色变成无色,且半分钟内不能恢复原来的颜色,酚酞的变色范围是8.2-10,滴定到终点时溶液显弱碱性,氢氧化钠稍微过量,c(Na+)>c(Cl-),
故答案为:滴加最后一滴溶液,锥形瓶溶液由红色变为无色,并30s保持不变 ; >;
a.锥形瓶用待测液润洗后再注入待测液,消耗标准溶液偏多,所以结果偏高;
b.碱式滴定管用待测液润洗,无影响;
c.酸式滴定管滴定前有气泡,滴定后无气泡,所以消耗标准溶液偏多,所以结果偏高;
d.酸式滴定管滴定后俯视读数,所以消耗标准溶液偏少,所以结果偏低,
故答案为:ac。
④酸碱中和滴定实验需要平行做2-3次实验,该实验只做一次实验,
故答案为:未进行平行实验
(3)①酸的电离平衡常数越大,则其相对应的酸根离子水解程度越小,相同浓度的钠盐溶液pH越小,酸性亚硫酸氢根离子大于次氯酸,
故答案为:大于;
②HSO3–的电离使溶液显酸性,HSO3–水解使溶液显碱性,可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法测溶液的pH值,
故答案为:测得溶液pH<7;
(3)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl +2HCl![]() NCl3 +3H2↑,
NCl3 +3H2↑,
故答案为:NH4Cl +2HCl![]() NCl3 +3H2↑ ;
NCl3 +3H2↑ ;
在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,发生NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液X中大量存在溶质有NaCl和NaOH,
故答案为:NaCl和NaOH。

 阅读快车系列答案
阅读快车系列答案【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
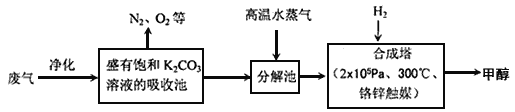
(1)吸收池中反应的化学方程式为K2CO3+CO2+H2O=2KHCO3,△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,其原因是 ____________________,_________________________
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____________。
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为___________________
(2)下列描述能说明反应达到平衡![]() 是_______
是_______
A.装置内CO和H2的浓度比值不再改变
B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变
D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)