题目内容
【题目】合成氨工业中的原料气制取与净化是重要的环节。
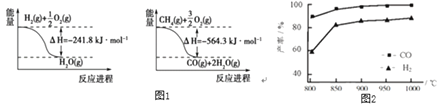
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
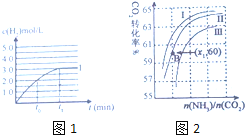
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
【答案】![]() ,
,![]()
![]()
![]() 时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低
时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低 ![]() 防止催化剂中毒 C
防止催化剂中毒 C
【解析】
(1)根据图1所示两幅能量图写出两个热化学方程式,根据盖斯定律计算所求反应的焓变;
(2)①焓变等于断裂化学键吸收的能量减去成键释放的能量;
②根据图示,温度越大,产率越大,但消耗能量高;
③K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算;
(3)根据外界条件对平衡移动的影响分析。
(1)①![]() ,
,
②![]() ,
,
根据盖斯定律②-3![]() ①得
①得![]() ,
,![]() ;
;
(2)①该反应的![]() 断裂化学键吸收能量
断裂化学键吸收能量![]() 形成化学键放出能量
形成化学键放出能量![]() ;
;
②从图象中可看出,900℃时,CO、![]() 的产率已经很高,若继续升高温度,产率增幅不大,但能耗升高,经济效益降低,所以实际生产中此反应优选温度为900℃;
的产率已经很高,若继续升高温度,产率增幅不大,但能耗升高,经济效益降低,所以实际生产中此反应优选温度为900℃;
③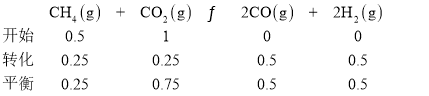
所以其平衡常数为:![]() ;
;
(3)由于CO易使催化剂中毒,所以必须除去原料气中CO;该反应是气体体积缩小的放热反应,低温高压促进反应向正反应方向进行,故选C。