题目内容
【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
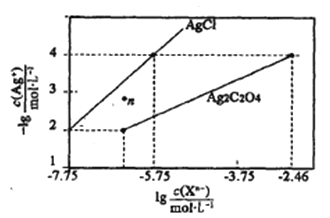
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
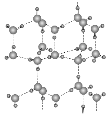
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
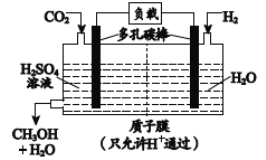
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。
【答案】CO(g)+2H2(g)![]() CH3OH(g) 升温或增大压强 bc -a+3y+n+x-2m 负 CO2+6H++6e-=CH3OH+H2O
CH3OH(g) 升温或增大压强 bc -a+3y+n+x-2m 负 CO2+6H++6e-=CH3OH+H2O
【解析】
化合反应是原子经济性反应,写出CO与H2反应合成甲醇的化学方程式。从化学反应速率的影响因素和化学平衡的判断分析。从断开化学键和形成新的化学键的能量差等于焓变进行计算。根据总的反应化学方程式中化合价的变化,写出各电极发生的化学反应。
(1)上述反应Ⅰ是原子经济性反应,理想的原子经济反应是原料分子中的原子百分之百地转变成产物,不产生副产物或废物,实现废物的“零排放”,故化学反应方程式为:CO(g)+2H2(g)![]() CH3OH(g);
CH3OH(g);
(2)提高上述反应Ⅱ的反应速率可以采用升温,加压等措施加快反应速率;
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2,都表示正反应方向的速率,不能代表处于平衡状态,故a不符合题意;
b.反应发生时容器内CH3OH的浓度是一个变值,容器内CH3OH的浓度不再改变代表化学反应达到平衡状态,故b符合题意;
c.反应是一个气体分子数减小的反应,也是一个压强减小的反应,当容器内气体压强不再改变代表达到平衡状态,故c符合题意;
d.由于是在容积固定的密闭容器中,则气体的密度是一个定值,若容器内气体密度不再改变,不能代表反应达到平衡状态,故d不符合题意;
答案选bc。
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ为:CO(g)+2H2(g)![]() CH3OH(g),则反应物断裂化学键键能之和减去生成物形成化学键键能之和等于生成1mol CH3OH放出的热量,得到的式子为:E1+2m-(3y+n+x)=-a,得到E1=-a+3y+n+x-2m;
CH3OH(g),则反应物断裂化学键键能之和减去生成物形成化学键键能之和等于生成1mol CH3OH放出的热量,得到的式子为:E1+2m-(3y+n+x)=-a,得到E1=-a+3y+n+x-2m;
(5) H2还原CO2电化学法制备甲醇的总反应为CO2+3H2=CH3OH+H2O,二氧化碳的化合价降低,在正极上得电子,正极反应为:CO2+6H++6e-=CH3OH+H2O,氢气的化合价升高,作负极,电极反应为3H2-6e-=6H+。

【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
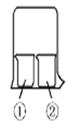
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
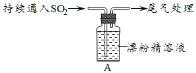
【题目】某小组对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.出现浑浊,溶液变为黄绿色; ⅱ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是______________________。
(3)甲同学认为现象i中溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是___________________。
(4)乙同学通过实验确定了A瓶中大量白色沉淀是CaSO4,并用离子方程式解释了现象ⅱ中黄绿色褪去的原因是________。