题目内容
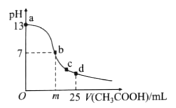
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是 ( )
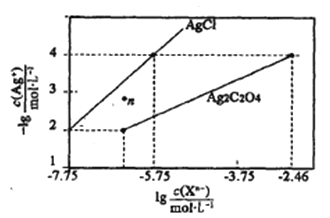
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c (Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4 +2Cl–(aq)2AgCl+C2O42-(aq)的平衡常数为109.04
【答案】D
【解析】
A.Ksp(Ag2C2O4)=c2(Ag+)·c(C2O42-)=(10-4)2×(10-2.46)=10-10.46,Ksp(Ag2C2O4)的数量级为10-11,故A错误;
B.在n点,c(Ag+)大于平衡浓度,故n点的浓度积Qc(AgCl)>Ksp(AgCl),n为氯化银的过饱和溶液,将有沉淀析出,故B错误;
C.由图象可知,c (Cl-)=c(C2O42-),当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,故向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C错误;
D.Ag2C2O4+2Cl-![]() 2AgCl+C2O42-的平衡常数K=
2AgCl+C2O42-的平衡常数K=![]() ,此时溶液中的c(Ag+)相同,故有:K=
,此时溶液中的c(Ag+)相同,故有:K=![]() =
=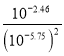 =109.04,故D正确。
=109.04,故D正确。
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
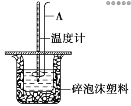
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。
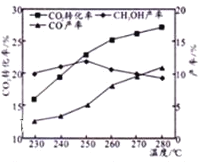
【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
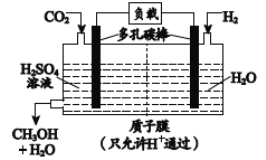
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。