题目内容
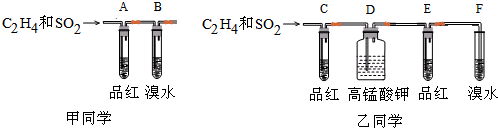
11.学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律.甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.
(1)写出选用物质的化学式:ANa2CO3、BNa2SiO3.根据实验目的,烧杯B中发生反应的离子方程式
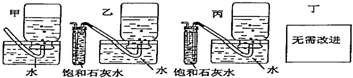
H2O+CO2+SiO32-═H2SiO3↓+CO32-,通过实验得出的结论:元素非金属性强弱顺序为S>C>Si.乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验.
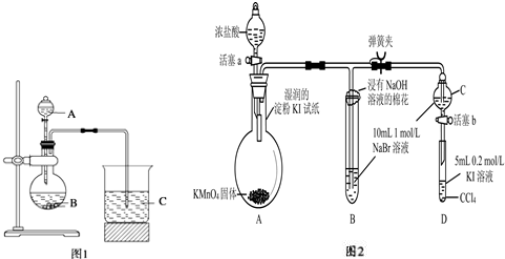
(2)乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为橙黄色时,立即关闭活塞a.
Ⅳ…
①B中溶液发生反应的离子方程式是Cl2+2Br-═Br2+2Cl-.
②为验证溴的氧化性强于碘,过程 IV的操作和现象是操作打开分液漏斗活塞,使C中的溶液流入试管D,关闭活塞b,取下试管D并振荡;现象下层溶液呈紫红色.
③过程 II实验的目的是防止Cl2过量,排除Cl2对Br2置换I2的干扰.
分析 (1)最高价氧化物酸性越强对应元素非金属性越强,依据强酸制备弱酸的原理,选择合适的试剂验证;
(2)浓盐酸与酸性的高锰酸钾反应生成氯气,氯气氧化性强于溴,能够置换溴,溴的氧化性强于碘,能够置换碘,碘溶于四氯化碳显紫红色,因为氯气的氧化性大于碘,所以验证溴的氧化性强于碘应排除氯气的干扰.
解答 解:(1)最高价氧化物酸性越强对应元素非金属性越强,依据强酸制备弱酸的原理,硫酸的酸性强于碳酸,碳酸的酸性强于硅酸,所以A为碳酸钠,B为硅酸钠,硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液发生反应:H2O+CO2+SiO32-═H2SiO3↓+CO32-,通过实验得出的结论:元素非金属性强弱顺序为S>C>Si,
故答案为:Na2CO3; Na2SiO3;H2O+CO2+SiO32-═H2SiO3↓+CO32-;S>C>Si;
(2)①氯气氧化性强于溴,所以氯气与溴离子反应生成氯离子和溴单质,离子方程式:Cl2+2Br-═Br2+2Cl-;
故答案为:Cl2+2Br-═Br2+2Cl-;
②溴的氧化性强于碘,能够置换碘,碘溶于四氯化碳显紫红色,所以验证溴的氧化性强于碘,过程 IV的操作是:打开分液漏斗活塞,使C中的溶液流入试管D,关闭活塞b,取下试管D并振荡;
现象是:下层溶液呈紫红色;
故答案为:打开分液漏斗活塞,使C中的溶液流入试管D,关闭活塞b,取下试管D并振荡;现象:下层溶液呈紫红色;
③因为氯气的氧化性强于溴,溴的氧化性强于碘,所以氯气的氧化性强于碘,实验Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹,是为了防止Cl2过量,排除Cl2对Br2置换I2的干扰;
故答案为:防止Cl2过量,排除Cl2对Br2置换I2的干扰.
点评 本题考查了检验物质性质实验方案的设计,明确非金属性强弱的判断依据,物质氧化性的强弱是解题关键,注意实验设计的严密性.

 名校课堂系列答案
名校课堂系列答案| A. | 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |

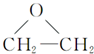 +CaCl2+H2O
+CaCl2+H2O