题目内容
19.将4mol A气体和2mol B气体在2L 的容器中混合,在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法:其中正确的是( )①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②2s时物质A的转化率为70%
③用物质B 表示的反应的平均速率为0.6mol•L-1•s-1
④2s时物质B的浓度为0.7mol•L-1.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
分析 ①根据v=△c△t计算v(C),再根据速率之比等于化学计量数之比计算v(A);
②计算C的物质的量变化量,根据方程式计算转化的A的物质的量,根据转化率定义计算A的转化率;
③利用速率之比等于化学计量数之比计算v(B);
④浓度变化量之比等于化学计量数之比,据此计算B的浓度变化量,进而计算2S时B的浓度.
解答 解:①2s后测得C的浓度为0.6mol•L-1,则v(C)=0.6mol/L2s=0.3mol/(L.min),速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol/(L.min),故①正确;
②C的物质的量变化为2L×0.6mol•L-1=1.2mol,根据方程式可知转化的A的物质的量=1.2mol,故A的转化率=1.2mol4mol×100%=30%,故②错误;
③速率之比等于化学计量数之比,故v(B)=12v(C)=12×0.3mol/(L.min)=0.15mol/(L.min),故③错误;
④浓度变化量之比等于化学计量数之比,故B的浓度变化量=12×0.6mol•L-1=0.3mol/L,故2S时B的浓度为2mol2L-0.3mol/L=0.7mol/L,故④正确,
故选B.
点评 本题考查化学平衡与化学反应速率的有关计算,难度不大,侧重对基础知识的巩固,注意反应速率通常利用定义法与速率规律计算.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
18.下列关于钠的叙述中,正确的是( )
| A. | 常温下,钠露置在空气中易被氧气氧化为过氧化钠,因此应保存在煤油里 | |
| B. | 钠是强还原剂,它能从盐溶液中置换出金属活动顺序表中排在钠后面的金属 | |
| C. | 钠蒸气充入灯泡中制成钠灯,常用于公路照明 | |
| D. | 金属钠着火时,能用水来灭火 |
19.下列反应属于取代反应的是( )
①Zn+2HCl=ZnCl2+H2↑
②Cu(OH)2+H2SO4═CuSO4+2H2O
③CH3CH3+2Cl2光→CH2ClCH2Cl+2HCl
④CH3COONa+NaOH一定条件→CH4↑+NaCO3.
①Zn+2HCl=ZnCl2+H2↑
②Cu(OH)2+H2SO4═CuSO4+2H2O
③CH3CH3+2Cl2光→CH2ClCH2Cl+2HCl
④CH3COONa+NaOH一定条件→CH4↑+NaCO3.
| A. | ③ | B. | ①③ | C. | ②④ | D. | ③④ |
14.现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如图:
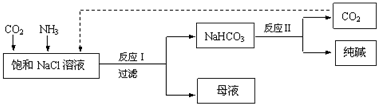
有关说法错误的是( )

有关说法错误的是( )
| A. | 反应Ⅰ原理为CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl | |
| B. | 向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 | |
| C. | 反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 | |
| D. | 往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
8.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
| A. | 原子半径:Y>Z>W | |
| B. | ZW2电子式为 | |
| C. | 片状Y在空气中点燃时现象不剧烈 | |
| D. | 已知XW2熔点为-107℃、沸点为12.5℃,熔融时不导电,可说明固态XW2为共价化合物 |
9.下列说法正确的是( )
①Na2CO3-制玻璃; ②SiO2-太阳能电池;③AgI-人工降雨;④Fe2O3-红色油漆或涂料;
⑤Al2O3-焊接钢轨;⑥NaClO-消毒剂; ⑦NaCl-制纯碱;⑧明矾-用于水的消毒、杀菌.
①Na2CO3-制玻璃; ②SiO2-太阳能电池;③AgI-人工降雨;④Fe2O3-红色油漆或涂料;
⑤Al2O3-焊接钢轨;⑥NaClO-消毒剂; ⑦NaCl-制纯碱;⑧明矾-用于水的消毒、杀菌.
| A. | ①②③⑥⑧ | B. | ②③⑤⑥⑦ | C. | ②③④⑥⑧ | D. | ①③④⑥⑦ |



 .
.