题目内容
1.实验室制取乙烯,常因温度过高浓硫酸氧化乙醇生成二氧化碳,而浓硫酸被还原为二氧化硫.有甲、乙两位同学分别设计了一种方案证明其中存在C2H4和SO2.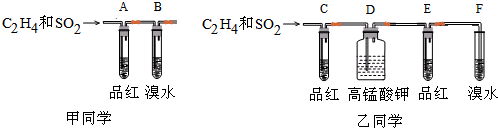
(1)甲同学得到的现象和结论为:品红溶液褪色,证明有SO2,溴水褪色,证明有C2H4.你认为甲同学的设计科学吗?请说明你的理由.不科学,未被品红吸收的SO2也可以是溴水褪色,干扰乙烯的检验;
(2)乙同学的设计中有一处明显的错误,请改正.把高锰酸钾换成NaOH溶液;
(3)在改正乙同学的错误后,再进行实验,能说明SO2存在的现象是C中品红褪色,确定含有乙烯的现象是E中品红不褪色,F中溴水褪色;
(4)乙烯通入溴水中的化学反应方程式CH2=CH2+Br2→CH2Br-CH2Br.
分析 (1)根据甲同学的实验装置可知,SO2和C2H4通过品红溶液,可以检验出SO2,但SO2不一定全被品红吸收,所以在试管B中溴水褪色的原因可以是C2H4,也可以是SO2;
(2)高锰酸钾能将乙烯氧化成二氧化碳;
(3)因为高锰酸钾能将乙烯氧化成二氧化碳,所以D装置中不能用高锰酸钾除二氧化硫,可以用氢氧化钠溶液除二氧化硫,根据二氧化硫能使品红褪色,乙烯能使溴水褪色答题;
(4)乙烯与溴水发生加成反应生成1,2-二溴乙烷.
解答 解:(1)根据甲同学的实验装置可知,SO2和C2H4通过品红溶液,可以检验出SO2,但SO2不一定全被品红吸收,所以在试管B中溴水褪色的原因可以是C2H4,也可以是SO2,所以甲同学的设计不科学,原因是未被品红吸收的SO2也可以是溴水褪色,干扰乙烯的检验,
故答案为:不科学,未被品红吸收的SO2也可以是溴水褪色,干扰乙烯的检验;
(2)高锰酸钾能将乙烯氧化成二氧化碳,所以装置D中应将把高锰酸钾换成NaOH溶液,
故答案为:把高锰酸钾换成NaOH溶液;
(3)因为高锰酸钾能将乙烯氧化成二氧化碳,所以D装置中不能用高锰酸钾除二氧化硫,可以用氢氧化钠溶液除二氧化硫,在改正后的实验中,能说明SO2存在的现象是 C中品红褪色,确定含有乙烯的现象是E中品红不褪色,F中溴水褪色,
故答案为:C中品红褪色;E中品红不褪色,F中溴水褪色;
(4)乙烯与溴水发生加成反应生成1,2-二溴乙烷,反应的化学反应方程式为CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br.
点评 本题主要考查了实验室制乙烯产物的检验,当有多种产物需检验时,应考虑先后顺序,掌握二氧化硫、乙烯的性质是解题的关键,难度中等.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 周期表中所有元素都是从自然界中发现的 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 原子结合成分子过程中一定释放出能量 |
9.下列说法正确的是( )
①Na2CO3-制玻璃; ②SiO2-太阳能电池;③AgI-人工降雨;④Fe2O3-红色油漆或涂料;
⑤Al2O3-焊接钢轨;⑥NaClO-消毒剂; ⑦NaCl-制纯碱;⑧明矾-用于水的消毒、杀菌.
①Na2CO3-制玻璃; ②SiO2-太阳能电池;③AgI-人工降雨;④Fe2O3-红色油漆或涂料;
⑤Al2O3-焊接钢轨;⑥NaClO-消毒剂; ⑦NaCl-制纯碱;⑧明矾-用于水的消毒、杀菌.
| A. | ①②③⑥⑧ | B. | ②③⑤⑥⑦ | C. | ②③④⑥⑧ | D. | ①③④⑥⑦ |
6.下列说法中,不正确的是( )
| A. | 若反应时形成新化学键释放的能量大于断裂旧化学键所吸收的能量,则该化学反应是释放能量的反应 | |
| B. | 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 化学反应必然伴随着能量的变化 |
13.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=H2O+SO32-.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-
假设2:既不存在SO32-,也不存在ClO-;
假设3:两种离子都存在(或者 只存在ClO-);.
②要证明假设1是否成立,设计实验方案,进行实验.请写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=H2O+SO32-.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-
假设2:既不存在SO32-,也不存在ClO-;
假设3:两种离子都存在(或者 只存在ClO-);.
②要证明假设1是否成立,设计实验方案,进行实验.请写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
10.氯碱工业中,与铁丝网连接的是电源的( )
| A. | 负极 | B. | 正极 | C. | 阴极 | D. | 阳极 |
11.在密闭容器内放入5molH2和5molN2,在某温度下经过反应生成2molNH3,此时密闭容器内压强是反应前压强的( )
| A. | 2倍 | B. | 1.5倍 | C. | 0.8倍 | D. | 0.5倍 |