题目内容
【题目】Ⅰ.在常温下,下列四种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4④0.1mol/L NH3H2O,请根据要求填写下列空白:
(1)溶液①呈____ 性(填“酸”、“碱”或“中”),其原因是______(用离子方程式表示)。
(2)在上述四种溶液中,pH最小的是________。
(3)比较四种溶液中c(NH4+)的由大到小的顺序是______________(填序号)。
(4)四种溶液中,离子浓度为0.1 mol/L的是___________(填离子符号)。
Ⅱ. KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所述:称取稍多于所需要的KMnO4固体溶于水中,将溶液加热并保持微沸1h;用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;过滤得到的KMnO4溶液贮存于棕色试剂瓶中并放在暗处;利用氧化还原反应滴定法,在70~80℃条件下用基准试剂溶液标定其浓度.
请回答下列问题:
(1)准确量取一定体积的KMnO4溶液需要使用的仪器是_____________。
(2)若选择H2C2O4 2H2O(M=126g/mol)作为基准试剂,准确称取Wg溶于水配成500mL溶液,配制溶液时,所用仪器除烧杯、胶头滴管和玻璃棒外,还需要_______。取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL,则KMnO4溶液的物质的量浓度为________mol/L。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ ③ ③﹥①﹥②﹥④ Cl- SO42- 酸式滴定管 500mL容量瓶
NH3·H2O+H+ ③ ③﹥①﹥②﹥④ Cl- SO42- 酸式滴定管 500mL容量瓶 ![]()
【解析】
Ⅰ.(1)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性。
(2)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性,②0.1mol/L CH3COONH4溶液中醋酸根离子和铵根离子水解程度相近溶液呈中性,③0.1mol/LNH4HSO4溶液电离出氢离子溶液显酸性,④0.1mol/LNH3·H2O 溶液中一水合氨电离溶液显碱性。
(3)铵根离子水解程度越大,离子浓度越小,④一水合氨难电离。
(4)四种溶液中,离子浓度为0.1mol/L的离子不发生水解。
Ⅱ.(1)高锰酸钾溶液具有强氧化性,不能使用碱式滴定管,可以选用酸式滴定管量取高锰酸钾溶液。
(2)配制一定浓度的溶液,应需要500mL容量瓶、烧杯、玻璃棒、胶头滴管等;先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度。
Ⅰ.(1)①0.1mol/LNH4Cl溶液中铵根离子水解溶液显酸性,![]() 。
。
故答案为:酸, ![]() 。
。
(2)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性,c(H+)<0.1mol·L-1;
②0.1mol/L CH3COONH4溶液中醋酸根离子和铵根离子水解程度相近溶液呈中性;
③0.1mol/L NH4HSO4溶液电离出氢离子溶液显酸性,c(H+)=0.1mol·L-1;
④0.1mol/L NH3H2O溶液中一水合氨电离溶液显碱性,①③相比较,③酸性较强,则酸性最强的是③。
故答案为:③。
(3)①②③中,铵根离子水解程度越大,离子浓度越小,④一水合氨弱电离,则四种溶液中![]() 的由大到小的顺序是③>①>②>④。
的由大到小的顺序是③>①>②>④。
故答案为:③>①>②>④。
(4)四种溶液中,离子浓度为0.1mol/L的离子不发生水解,应为Cl- 、SO42-。
故答案为:Cl- 、SO42-。
Ⅱ.(1)高锰酸钾溶液具有强氧化性,量取时应该选用酸式滴定管。
故答案为:酸式滴定管。
(2)配制一定浓度的溶液,应需要500mL容量瓶、烧杯、玻璃棒、胶头滴管等,滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点;草酸的物质的量浓度为: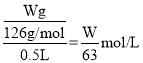 ,根据反应方程式
,根据反应方程式
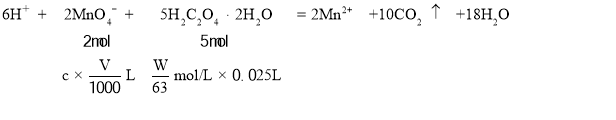
酸性高锰酸钾的物质的量浓度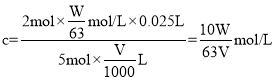 ,
,
故答案为:500mL容量瓶; ![]() 。
。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案