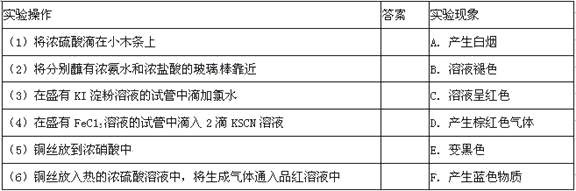
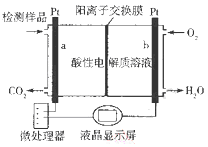
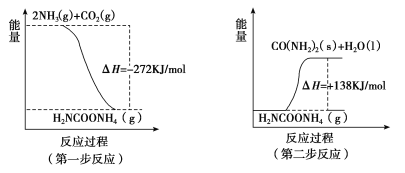
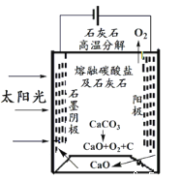
题目内容
【题目】 常温下,醋酸和氨水的电离平衡常数均为1.8×10-5。向10mL浓度为0.1molL-1的NH3H2O溶液中滴加相同浓度的CH3COOH(温度变化忽略不计),在滴加过程中( )
A.c(NH4+)与c(NH3H2O)之和始终保持不变
B.水的电离程度始终增大
C.![]() 始终减小
始终减小
D.当加入CH3COOH的体积为10mL时,溶液pH>7
【答案】C
【解析】
试题分析:A.溶液的体积增大,n(NH4+)与n(NH3H2O)的和不变,所以c(NH4+)与c(NH3H2O)之和减小,故A错误;B.开始时,溶液的碱性逐渐减弱,氢氧根离子浓度减小,水的电离程度逐渐增大,当醋酸过量后,溶液中氢离子浓度逐渐增大,水的电离程度逐渐减小,故B错误;C.已知Ka=![]() 只与温度有关,加醋酸,溶液中氨水的浓度减小,则氢离子浓度增大,所以
只与温度有关,加醋酸,溶液中氨水的浓度减小,则氢离子浓度增大,所以![]() 减小,故C正确;D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,故D错误。故选C。
减小,故C正确;D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,故D错误。故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目