题目内容
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
【答案】AB
【解析】
试题分析:A.当V=0时为碳酸钠溶液,根据电荷守恒可知:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),根据物料守恒可得:c(Na+)=2c(HCO3-)+2c(H2CO3)+2c(CO32-),根据电荷守恒和物料守恒可得:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),故A错误;B.当V=5时,碳酸钠与氯化氢浓度相等,则氯离子的物质的量为总的碳原子的物质的量一半,根据物料守恒可得:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-),故B正确;C.当V=10时,此时恰好反应生成碳酸氢钠,碳酸氢钠溶液中碳酸氢根离子的水解大于其电离程度,则碳酸的浓度大于碳酸根离子,即c(CO32-)<c(H2CO3),正确的离子浓度大小关系为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;D.v=a时,溶液为中性,c(H+)=c(OH-),根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(Cl-)+c(HCO3-),则c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-),所以c(Na+)>c(Cl-)>c(H+)=c(OH-),故D正确;故选BD。
【名师点晴】高频考点,首先明确溶液的组成,并注意掌握溶液中盐的水解原理、弱电解质的电离平衡及离子浓度大小比较的方法,需要准确运用溶液中存在的电荷守恒、物料守恒及质子守恒在离子浓度大小比较中应用方法即可解决相关判断。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
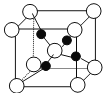
①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
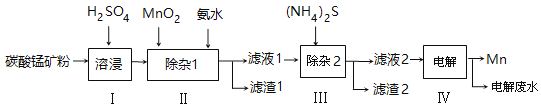
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)