题目内容
【题目】运用化学反应原理研究碳、氮等单质和化合物的反应有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图如下:
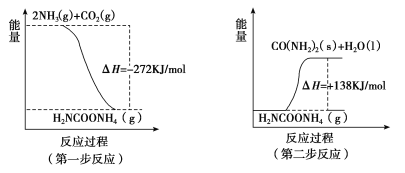
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
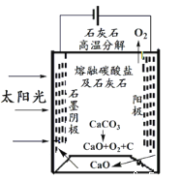
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为_________________。
【答案】
(1)①2 ;②+18.7 kJ·mol-1
(2)2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-134 kJ·mol-1
(3)负极;2NH3+6OH-6e―= N2+6H2O;
(4)①a、c;②2 CO32--4e-===2CO2↑+O2↑
【解析】
试题分析:(1)①6FeO(s)+CO2(g)═2Fe3O4(s)+C(g)△H=-76.0KJmol-1该反应中每生成1molFe3O4,反应的二氧化碳物质的量为0.5mol,1mol二氧化碳反应转移电子4mol,0.5mol二氧化碳反应转移电子2mol,所以转移电子的物质的量2mol,故答案为:2;
②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJmol-1,C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJmol-1,
两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H=(-76.0kJ/mol+113.4kJ/mol)÷2 =+18.7kJ/mol,故答案为:+18.7kJ/mol;
(2)由图示可知,两步反应的完成的热效应与一步完成的热效应是相同的,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol,故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l) △H=-134 kJ/mol;
(3)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-→N2+6H2O,故答案为:负极;2NH3-6e-+6OH-→N2+6H2O;
(4)①依据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:ac;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应为:2CO32--4e-═2CO2↑+O2↑,故答案为:2CO32--4e-═2CO2↑+O2

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
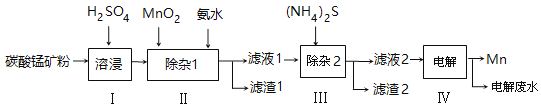
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)