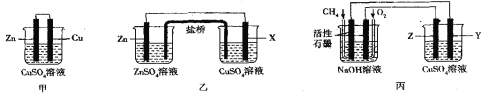
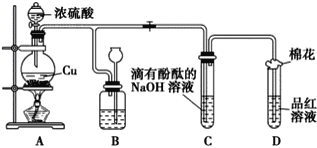
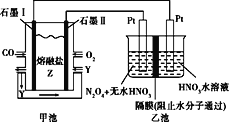
题目内容
【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。
【答案】Ar Al(OH)3+OH-=AlO2-+2H2O K>Na>Mg H2O>HBr>HCl ![]() 2K+2H2O=2KOH+H2↑ AB 最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br
2K+2H2O=2KOH+H2↑ AB 最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br
【解析】
由元素在周期表的位置可知,A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar,结合原子结构和元素周期律分析解答。
由元素在周期表的位置可知,A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar。
(1)元素周期表中化学性质最不活泼是稀有气体元素,即Ar的性质最不活泼,故答案为:Ar;
(2)铝元素最高价氧化物对应的水化物为氢氧化铝,氢氧化铝是两性氢氧化物,能与氢氧化钠反应,反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)一般而言,电子层越多,半径越大,所以K的半径最大,电子层数相同时,原子序数越小,半径越大,则Na>Mg,所以原子半径大小为K>Na>Mg,故答案为:K>Na>Mg;
(4)H2O分子间存在氢键,沸点最高;HCl和HBr都是分子晶体,相对分子量越大,沸点越高,则沸点:HBr>HCl,所以沸点高低为:H2O>HBr>HCl,故答案为:H2O>HBr>HCl;
(5)E为C元素,其氧化物若为二氧化碳,属于共价化合物,其电子式为![]() ;F是O,氢化物为水,K与水反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:
;F是O,氢化物为水,K与水反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:![]() ;2K+2H2O=2KOH+H2↑;
;2K+2H2O=2KOH+H2↑;
(6)A.金属性越强,对应最高价氧化物对应水化物的碱性越强,金属性:Al<Mg,则碱性:Al(OH)3<Mg(OH)2,可用元素周期律解释,故A选;B.非金属性越强,对应氢化物越稳定,稳定性:HCl<HF,可用元素周期律解释,故B选;C.Cu与氯化铁发生氧化还原反应,与元素周期律无关,不能用元素周期律解释,故C不选;故答案为:AB;
(7)G的单质可以从NaBr溶液中置换出Br2单质,因为Cl和Br的最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br,故答案为:最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D