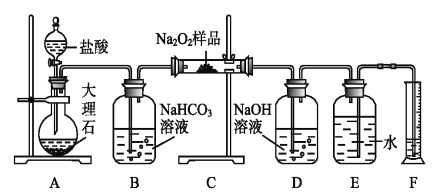
题目内容
【题目】I.工业金属钛冶炼过程中有一步将原料金红石转化,其反应方程式为:TiO2(金红石)+2C+2Cl2=TiCl4+2CO
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是___。
(2)请写出金红石转化的热化学方程式___。
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:
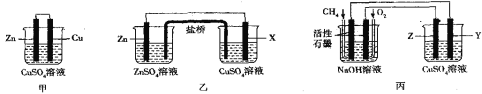
(1)甲装置中铜电极上的电极反应式为___。
(2)放电时盐桥中的Cl-将会出现在乙装置__(填“左”或“右”)侧的容器中,X电极的成分不可能是__(填字母)
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是__(填“Y或Z”),负极上的电极反应式为___。
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是___。
【答案】283kJ/mol(或△H=-283 kJ/mol) TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g) △H=-80kJ/mol Cu2++2e-=Cu 左 d Y CH4+10OH--8e-=CO32-+7H2O 0.28L
【解析】
Ⅰ.(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(2)依据热化学方程式和盖斯定律计算焓变,并写出热化学方程式;
Ⅱ.(1)Zn比Cu活泼,作负极,Cu作正极,据此写出正极反应式;
(2)在乙图装置中,Zn作负极、X作正极,盐桥中的Cl-将向负极移动;由Zn+Cu2+═Zn2++Cu可知,X电极活泼性需要小于Zn;
(3)丙装置中,左装置为碱性燃料电池,燃料甲烷所在电极为负极,通入O2的电极为正极,则右装置为电解池,Z电极为阳极,Y电极为阳极,铁上镀铜时 纯铜为阳极,铁作阴极,硫酸铜溶液作电解质;
(4)丙装置中,纯铜为阳极,铁作阴极,根据电子守恒得到关系式为2Cu~4e-~O2,阳极Cu电极减少1.6gCu时,物质的量为0.025mol,据此计算O2的物质的量和体积。
Ⅰ.(1)2CO(g)+O2(g)═2CO2(g)△H=-566kJmol-1,燃烧热的热化学方程式为:CO(g)+![]() O2(g)═CO2(g)△H=-283 kJ/mol,则CO燃烧热为283kJ/mol,故答案为:283kJ/mol(或△H=-283 kJ/mol);
O2(g)═CO2(g)△H=-283 kJ/mol,则CO燃烧热为283kJ/mol,故答案为:283kJ/mol(或△H=-283 kJ/mol);
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJmol-1,②2CO(g)+O2(g)═2CO2(g)△H=-566 kJmol-1,③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141 kJmol-1,根据盖斯定律,将①×2-②+③得到:TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)△H=(-393.5kJmol-1)×2-(-566 kJmol-1)+(+141 kJmol-1)=-80 kJ/mol,故答案为:TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)△H=-80kJ/mol;
Ⅱ.(1)Zn比Cu活泼,Zn为负极,发生失去电子的氧化反应,Cu作正极,正极上Cu2+得电子生成Cu,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)在乙图装置中,Zn易失电子、作负极,X作正极,放电时盐桥中的Cl-将向负极移动,即向左移动,盐桥中的Cl-将会出现在左侧的容器中;由Zn+Cu2+═Zn2++Cu可知,X电极活泼性小于Zn,铜、铁、石墨的活泼性均小于Zn,不可能发生失去电子的反应,Al比Zn活泼,若X为Al,则Al作负极,原电池反应发生改变,故答案为:左;d;
(3)丙装置中,左侧装置为碱性燃料电池,燃料甲烷发生失去电子的氧化反应,所在电极为负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入O2的电极为正极,则右装置为电解池,Z电极为阳极,Y电极为阴极,在铁上镀铜时 纯铜为阳极,铁作阴极,即电极材料为铁的是Y,故答案为:Y;CH4+10OH--8e-=CO32-+7H2O;
(4)丙池为电解池,其中某电极的质量减少1.6g,是阳极Cu电极减少1.6g,物质的量为![]() =0.025mol,整个装置中关系式为2Cu~4e-~O2,n(O2)=
=0.025mol,整个装置中关系式为2Cu~4e-~O2,n(O2)=![]() n(Cu)=0.0125mol,在标况下的体积V=nVm=0.0125mol×22.4L/mol=0.28L,故答案为:0.28L。
n(Cu)=0.0125mol,在标况下的体积V=nVm=0.0125mol×22.4L/mol=0.28L,故答案为:0.28L。

【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。