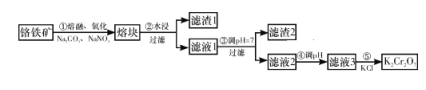
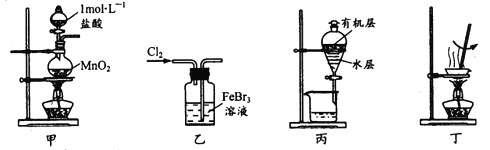
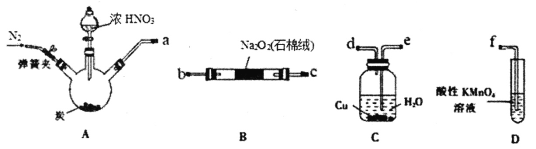
题目内容
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4 溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() ―→Mn2++NO3-+H2O。下列叙述中正确的是
―→Mn2++NO3-+H2O。下列叙述中正确的是
A. 该反应中NO2-被还原
B. 反应过程中溶液的pH增大
C. 生成1 mol NaNO3需消耗0.2 mol KMnO4
D. ![]() 中的粒子是OH-
中的粒子是OH-
【答案】B
【解析】
该反应中锰元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,结合元素守恒和电荷守恒分析解答。
A.该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化,故A错误;
B.根据元素守恒和电荷守恒知,![]() 是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B正确;
是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B正确;
C.根据转移的电子守恒,生成1molNaNO3需消耗KMnO4的物质的量=![]() =0.4mol,故C错误;
=0.4mol,故C错误;
D.根据元素守恒和电荷守恒知,![]() 是H+,故D错误。
是H+,故D错误。
答案选B。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。