题目内容
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是
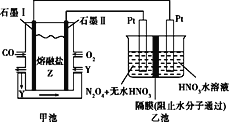
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.石墨Ⅰ的电极反应式:CO+CO32--2e-=2CO2
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
【答案】B
【解析】
A.CO发生氧化反应是负极,则石墨Ⅰ是原电池的负极,发生氧化反应,故A正确;
B.原电池中阴离子向负极移动,所以甲池中的CO32﹣向石墨I极移动,故B错误;
C.石墨Ⅰ是原电池的负极,CO发生氧化反应,电极反应式为CO+CO32﹣﹣2e﹣═2CO2,故C正确;
D.若甲池消耗标准状况下的氧气2.24L即0.1mol,整个电路转移电子的物质的量为0.4mol,而乙池中阴极若生成1mol氢气,则转移2mol的电子,所以根据得失电子守恒知生成氢气的物质的量为0.2mol,故D正确;
故答案为B。

【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。