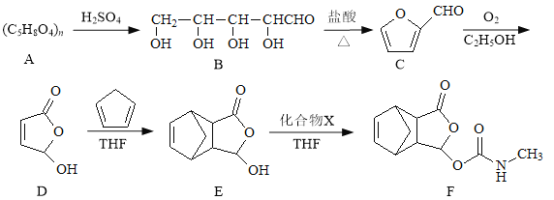
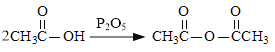
题目内容
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产。气相直接合成的反应为:C2H4(g)+H2O(g)![]() C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
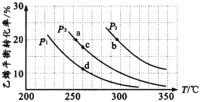
(l)P2时,若起始n(H2O)=n(C2H4)=lmol,容器体积为1L,反应经5 min达到a点,在0~5 min时段,反应速率v(C2H5OH)为____mol/(Lmin),a点的平衡常数Ka=______(保留两位小数)。
(2)乙烯气相直接水合反应的ΔH____0(填“>”或“<”),相同起始量达到a、b所需要的时间ta__tb(填“>”、“<”或“=”,后同)。c、d两点的平衡常数Kc____Kd。
(3)300℃时,要提高乙烯的平衡转化率可采取的措施有______、______ 、___。
【答案】0.04 0.31 < > = 增大压强 增大H2O的浓度[或增大n(H2O) 与n(C2 H4)投料比] 及时分离出生成的乙醇
【解析】
根据化学反应速率的计算公式及平衡常数的表达式进行相关计算;分析图像中乙烯的平衡转化率受温度的影响确定反应是放热反应;根据压强对化学平衡的影响分析压强的大小关系,进一步比较相关的化学反应速率的大小;根据影响化学平衡移动的因素及平衡移动原理选择合适的措施。
(l)P2时,若起始n(H2O)=n(C2H4)=lmol,容器体积为1L,反应经5 min达到a点,由图中信息可知,此时乙烯的转化率为20%,在0~5 min时段,乙烯的变化量为0.2mol,则乙醇的变化量也是0.2mol,反应速率v(C2H5OH)为![]() mol/(Lmin)。a点,C2H4、H2O、C2H5OH的平衡浓度分别为0.8mol/L、0.8mol/L、0.2mol/L,a点的平衡常数Ka=
mol/(Lmin)。a点,C2H4、H2O、C2H5OH的平衡浓度分别为0.8mol/L、0.8mol/L、0.2mol/L,a点的平衡常数Ka=![]() 。
。
(2)由图中信息可知,乙烯的平衡转化率随着温度的升高而减小,说明温度升高该平衡向逆反应方向移动,故乙烯气相直接水合反应的ΔH<0。C2H4(g)+H2O(g)![]() C2H5OH(g)该反应正反应方向是气体分子数减小的方向,压强越大,乙烯的平衡转化率越大,由图中信息可知,在相同温度下,P3的转化率大于P2,则P3的压强较大,b点的温度、压强都比a点大,温度越高、压强越大,化学反应速率越大,达到平衡所用的时间越短,因此,相同起始量达到a、b所需要的时间ta>tb。c、d两点对应的温度相同,因为平衡常数只受温度影响,则平衡常数Kc=Kd。
C2H5OH(g)该反应正反应方向是气体分子数减小的方向,压强越大,乙烯的平衡转化率越大,由图中信息可知,在相同温度下,P3的转化率大于P2,则P3的压强较大,b点的温度、压强都比a点大,温度越高、压强越大,化学反应速率越大,达到平衡所用的时间越短,因此,相同起始量达到a、b所需要的时间ta>tb。c、d两点对应的温度相同,因为平衡常数只受温度影响,则平衡常数Kc=Kd。
(3)300℃时,要提高乙烯的平衡转化率,应设法让化学平衡向正反应方向移动,根据平衡移动原理可知,可采取的措施有:增大压强、增大H2O的浓度[或增大n(H2O) 与n(C2H4)投料比]、及时分离出生成的乙醇。

【题目】某矿石的主要成分是BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用该矿石制备BaCl2·2H2O的流程如图:
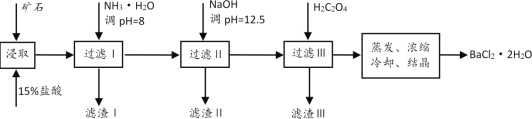
(1)用稀盐酸浸取前需充分研磨矿石,目的是__。
(2)加入NH3·H2O调节pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)要使Ca2+完全沉淀,应控制溶液中的![]() 的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
(4)利用氧化还原滴定法可测定H2C2O4的浓度,取20.00mLH2C2O4溶液于锥形瓶中,用0.10mol/L酸性KMnO4溶液滴定,KMnO4溶液应装在__(填“酸式滴定管”或“碱式滴定管”)中。写出反应的离子方程式为__。滴定终点的现象为__。若滴定达到终点时,消耗KMnO4溶液30.00mL,则H2C2O4溶液的浓度为__mol/L。