题目内容
【题目】下列叙述不正确的是( )
A.24g镁与27g铝中,质子数之比为12∶13
B.相同质量的16O2和18O2,体积比为9∶8
C.将1LCmol·L-1氯化钠溶液加入水中稀释为5L,得到0.2Cmol·L-1氯化钠溶液
D.同温同压时,H2和CH4两种气体的密度之比为1∶8
【答案】B
【解析】
A.24gMg的物质的量为![]() =1mol,所含质子数为12NA;27gAl的物质的量为
=1mol,所含质子数为12NA;27gAl的物质的量为![]() =1mol,所含质子数为13NA,则二者所含质子数之比为12:13,故A正确,但不符合题意;
=1mol,所含质子数为13NA,则二者所含质子数之比为12:13,故A正确,但不符合题意;
B.没有说明外界条件相同,不能比较不同气体的体积比,故B错误,符合题意;
C.根据c=![]() ,在稀释过程中,溶质的物质的量不变,溶液的体积变为原来的5倍,则浓度变为原来的
,在稀释过程中,溶质的物质的量不变,溶液的体积变为原来的5倍,则浓度变为原来的![]() ,故C正确,但不符合题意;
,故C正确,但不符合题意;
D.根据阿伏加德罗定律的推论可知,同温同压下气体的密度之比等于它们的摩尔质量之比,则,H2和CH4在同温同压下的密度之比=2g/mol:16g/mol=1:8,故D正确,但不符合题意;
故选:B。

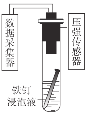
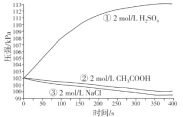
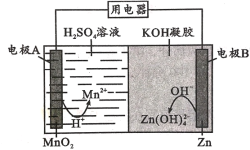
【题目】探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:
实验装置 | 实验数据 |
|
|
下列说法不正确的是
A.①的负极反应:Fe-3e-=Fe3+
B.③的正极反应:O2+2H2O+4e-=4OH-
C.②可能同时发生析氢腐蚀和吸氧腐蚀
D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关
【题目】纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
Ⅰ.世界最早工业生成纯碱的方法是路布兰(N.Leblanc)法,其流程如图:

(1)流程Ⅰ的反应是___反应(填“氧化还原”或“非氧化还原"),流程Ⅱ的反应是分步进行的,a.Na2SO4(s)与过量木炭反应生成Na2S(s);b.Na2S(s)与石灰石发生复分解反应生成Na2CO3,a步的反应化学方程式为___。
Ⅱ.19世纪60年代后生产纯碱的路布兰法被索尔维(E.Solvay)氨碱法所取代,其生产流程如图:
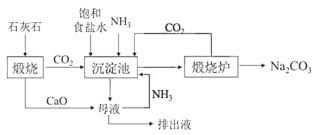
(2)氨碱法中加入NH3的主要作用是___。
(3)与路布兰法相比,氨碱法的优点有___。(写出一条即可)
Ⅲ.1939年候德榜首先提出并自行设计了联合制碱法——利用合成氨工业上的NH3和CO2和NaCl为原料生产纯碱。
(4)侯德榜制碱法的关键还在于对从反应后的混合物中分离出NaHCO3后所得溶液的处理:在溶液中加入NaCl固体并通入NH3,并在___(填温度范围)下析出NH4Cl。
表1不同温度下NaCl和NH4Cl的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |