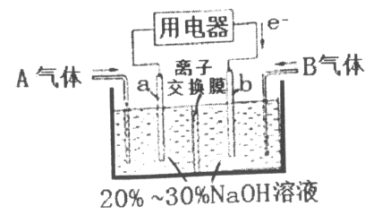
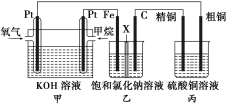
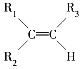
题目内容
【题目】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A (g)+3B (g)![]() 2C (g)达到平衡的说法中,正确的组合是
2C (g)达到平衡的说法中,正确的组合是
①C 的生成速率和 C 的分解速率相等
②单位时间内生成 a mol A,同时生成 3a mol B
③气体密度不再变化
④ 混合气体的平均相对分子质量不变
⑤A、B、C 的物质的量之比为 1∶3∶2
A.①④B.②③⑤C.①④⑤D.④⑤
【答案】A
【解析】
A (g)+3B (g)![]() 2C (g)
2C (g)
①C的生成速率与C的分解速率相等,故正逆反应速率相等,反应达到平衡,故①正确;
②单位时间内生成 a mol A是逆反应,同时生成 3a mol B也是逆反应,未体现正与逆的关系,不能判断平衡状态,故②错误;
③密度=![]() ,气体的总质量不变,体积不变,故气体密度不再变化不可作为判断是否达到平衡状态的依据,故③错误;
,气体的总质量不变,体积不变,故气体密度不再变化不可作为判断是否达到平衡状态的依据,故③错误;
④平均相对分子质量=![]() ,总质量不变,总物质的量会变,当平均相对分子质量不变时,反应达到平衡状态,故④正确;
,总质量不变,总物质的量会变,当平均相对分子质量不变时,反应达到平衡状态,故④正确;
⑤平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故A、B、C的物质的量比为1:3:2不能作为判断是否达到平衡状态的依据,故⑤错误;
说法正确的为①④,答案选A。

【题目】实现 “节能减排” 和“低碳经济”是化学工作者研究的重要课题。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)CO2和H2充入一定体积的密闭容器中,两种温度下CH3OH的物质的量随时间的变化见图1。曲线I、Ⅱ对应的平衡常数大小关系为KⅠ____KⅡ(填“>”、“<”或“=”)。

(2)某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图2曲线(甲)所示。
①a点正反应速率_________逆反应速率(填“>”、“<”或“=”);
0-10min内v(CH3OH) =__________mol·L-1·min-1。
②若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______填序号)。
A.加催化剂 B.增大压强
C.升高温度 D.增大CO2浓度
(3)830 ℃,反应的平衡常数K=1。在2L恒容反应器中发生上述反应,按下表中A、B、C、D四组的物质的量投入反应混合物,其中向正反应方向进行的有_____(填序号)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 0 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 0 | 2 | 3 | 2 |
(4)研究发现,在相同条件下还发生另一个平行反应CO2(g)+H2(g)![]() CO(g)+H2O(g)。CO2与H2用量相同,使用不同的催化剂时,产物中CO与CH3OH比例有较大差异,其原因是__________________________ 。
CO(g)+H2O(g)。CO2与H2用量相同,使用不同的催化剂时,产物中CO与CH3OH比例有较大差异,其原因是__________________________ 。
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
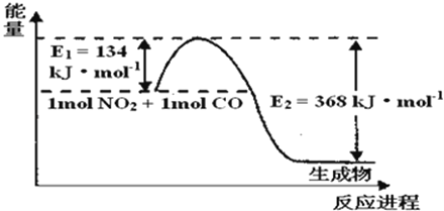
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。