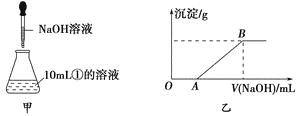
题目内容
【题目】如图,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中的X为阳离子交换膜。请按要求回答相关问题:
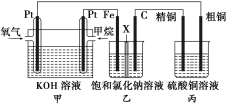
(1)甲烷燃料电池的负极反应为__________________________。
(2)石墨(C)极的电极反应为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的体积为________L。
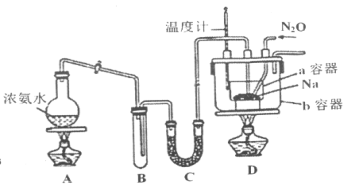
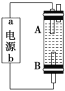
(4)某同学利用甲烷燃料电池设计电解法制取漂白液的实验装置(如图)。若用于制漂白液,a为电池的______极,电解质溶液最好用______________。
【答案】CH4-8e-+10OH-===CO32-+7H2O 2Cl--2e-===Cl2↑ 4.48 负 饱和氯化钠溶液(或饱和食盐水)
【解析】
通常,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极。
(1)该燃料电池中,通入甲烷的电极是负极,发生氧化反应,电极反应式为:CH4-8e-+10OH-==CO32-+7H2O,注意碱性介质,用OH-配电荷守恒。所以,本题正确答案是:CH4-8e-+10OH-==CO32-+7H2O;(2)乙装置是一个电解池,其中石墨电极连接左侧燃料电池的正极,作阳极,氯离子失电子,发生氧化反应,电极反应式为:2Cl--2e-===Cl2↑。因此,本题的正确答案是:2Cl--2e-==Cl2↑;(3)据得失电子守恒,左侧燃料电池中得失电子数等于乙装置中得失电子数。若在标准状况下有2.24L氧气参加反应,则转移电子的物质的量为0.4mol。乙装置中铁电极是阴极,得到0.4mol电子,生成0.2mol H2,H2在标准状况下的体积为4.48L。本题正确答案是4.48;(4)漂白液的有效成分是次氯酸钠,其制备原理是:先用惰性电极电解饱和食盐水制得氯气、氢氧化钠和氢气,再将氯气与产生的NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O,从装置设计角度来看,气体与液体反应,气体如在下端产生,能更充分地与溶液接触、反应,所以该装置的B端与电源的正极相连作阳极,A端与电源负极相连作阴极,电解质溶液选用饱和食盐水。本题答案为:负 饱和氯化钠溶液(或饱和食盐水)。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】Ⅰ.某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.800g 试样溶于水,加入过量KI 固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3 标准溶液滴定,到达滴定终点时,平均消耗Na2S2O3 标准溶液40.00 mL。(已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O32-=S4O62-+2I-。)
(1)可选用________作滴定指示剂,滴定终点的现象是________________。
(2)该试样中CuCl2·2H2O 的质量百分数为________________。
Ⅱ.25℃,两种酸的电离平衡常数如表,按要求回答下列问题。
K1 | K2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)用离子方程式表示亚硫酸钠溶液呈碱性的原因________________________________。
(2)浓度均为0.1mol/L的Na2SO3和Na2CO3的溶液中SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________________________。
(3)亚硫酸钠溶液中通入少量CO2气体的化学方程式________________________________。