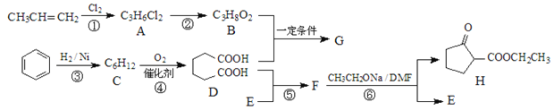
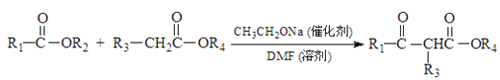
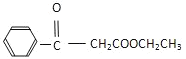题目内容
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
【答案】C
【解析】
A.①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0 平衡常数K1=
NaNO3(s)+ClNO(g) △H1<0 平衡常数K1=![]()
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2 =
2ClNO(g) △H2<0 平衡常数K2 =![]()
反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数K=![]() ,则K=
,则K=![]() ,A正确;
,A正确;
B.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin),则平衡时n(ClNO)=7.5×10-3 mol/(Lmin)×10min×2L=0.15mol,设①中反应的NO2为xmol,②中反应的Cl2为ymol,则:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)
NaNO3(s)+ClNO(g)
xmol 0.5xmol
2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
2ymol ymol 2ymol
则0.5x+2y=0.15,(0.2-x+0.2-2y+0.1-y)+0.5x+2y=0.4,联立方程,解得x=0.1、y=0.05,故平衡后c(Cl2)=![]() =2.5×10-2mol/L,B正确;
=2.5×10-2mol/L,B正确;
C.平衡常数只受温度影响,其他条件保持不变,反应在恒压条件下进行,则平衡常数K2不变,C错误;
D.平衡时NO2的转化率为![]() ×100%=50%,D正确;
×100%=50%,D正确;
故合理选项是C。

【题目】Ⅰ.某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.800g 试样溶于水,加入过量KI 固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3 标准溶液滴定,到达滴定终点时,平均消耗Na2S2O3 标准溶液40.00 mL。(已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O32-=S4O62-+2I-。)
(1)可选用________作滴定指示剂,滴定终点的现象是________________。
(2)该试样中CuCl2·2H2O 的质量百分数为________________。
Ⅱ.25℃,两种酸的电离平衡常数如表,按要求回答下列问题。
K1 | K2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)用离子方程式表示亚硫酸钠溶液呈碱性的原因________________________________。
(2)浓度均为0.1mol/L的Na2SO3和Na2CO3的溶液中SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________________________。
(3)亚硫酸钠溶液中通入少量CO2气体的化学方程式________________________________。