题目内容
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4·5H2O。工艺流程如下
(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加H2O2溶液,稍加热。
III.向II的溶液中加入CuO粉末至pH=4。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1。
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体。
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
| 物质 | Fe(OH)3 | Fe (OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10–38 | 8.0×10–16 | 2.2×10–20 |
(1)II中发生反应的离子方程式是 。
(2)II中将Fe2+氧化为Fe3+的目的是 。
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是 。
(4)III中发生反应的离子方程式是 。
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全________________________(提示:当溶液中某离子浓度小于1.0×10–5 mol/L时可认为该离子沉淀完全)。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因 。
(1)2Fe2+ +H2O2+2H+=2Fe3++2H2O (2分) (2)在调节pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀。(表述合理即可得分) (2分)
(3)若有蓝色沉淀生成,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化。(只答出其中一种情况,表述正确得满分。) (1分)
(4)Fe3++3H2O Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O (或只书写第二个反应也可得分)
Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O (或只书写第二个反应也可得分)
或2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ (2分)
c(Fe3+)= =4.0×10–8 mol·L–1<1.0×10–5 mol·L–1,故Fe3+沉淀完全 (2分)
=4.0×10–8 mol·L–1<1.0×10–5 mol·L–1,故Fe3+沉淀完全 (2分)
(5)用稀硫酸酸化至pH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体。(表述合理即可得分) (1分)
解析试题分析:(1)由于溶液中含有亚铁离子,需要将其氧化为铁离子除去。双氧水具有氧化性,因此向滤液中滴加H2O2溶液,稍加热的目的是除去亚铁离子,反应的离子方程式为2Fe2+ +H2O2+2H+=2Fe3++2H2O。
(2)由于亚铁离子沉淀时的pH值大于铜离子沉淀时的pH值,而铁离子完全沉淀时的pH值是3.7,所以II中将Fe2+氧化为Fe3+的目的是在调节pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀。
(3)由于铁氰化钾与亚铁离子结合产生蓝色沉淀,据此可以检验亚铁离子。即若有蓝色沉淀生成,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化。
(4)氧化铜能消耗氢离子,降低溶液的酸性,从而产生氢氧化铁沉淀,因此反应的离子方程式为Fe3++3H2O Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O;氢氧化铁的溶度积常数是4.0×10–38,则当溶液中OH-等于10-10mol/L时,则此时溶液中c(Fe3+)=
Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O;氢氧化铁的溶度积常数是4.0×10–38,则当溶液中OH-等于10-10mol/L时,则此时溶液中c(Fe3+)= =4.0×10-8 mol·L-1<1×10-5 mol·L-1,故Fe3+沉淀完全。
=4.0×10-8 mol·L-1<1×10-5 mol·L-1,故Fe3+沉淀完全。
(5)由于铜离子水解,溶液显酸性,所以用稀硫酸酸化至pH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体。
考点:考查硫酸铜晶体制备、氧化还原反应、亚铁离子检验、盐类水解以及溶度积常数的有关计算

工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 | HA物质的量 浓度/(mol·L-1) | NaOH物质的量 浓度/(mol·L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________________。
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(只列式):c(Na+)-c(A-)=________mol·L-1。
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-、HB-
 H++B2-
H++B2-回答下列问题:
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
某学生欲用已知物质的量浓度的醋酸来测定未知物质的量浓度的氢氧化钠溶液时,选择适当的指示剂。请填写下列空白:
(1)用标准醋酸滴定待测的氢氧化钠溶液时,从下列选项中选出最恰当的一项________。
| | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
滴定时应左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到加入一滴醋酸后,溶液颜色由 色变为 色,并在半分钟内溶液颜色不改变为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的是 。
A.酸式滴定管未用标准醋酸润洗就直接注入标准醋酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取醋酸体积时,开始仰视读数,滴定结束后俯视读数
(3)某学生根据3次实验分别记录有关数据如表:
| | 待测氢氧化钠 | 0.100mol/L醋酸的体积 | |
| 滴定次数 | 溶液的体积(ml) | 滴定前的刻度(ml) | 滴定后的刻度(ml) |
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
依据上表数据计算该氢氧化钠溶液的物质的量浓度为 。
(4)下图为上述25 mL NaOH溶液中逐滴滴加CH3COOH溶液过程中溶液pH的变化曲线,请回答:
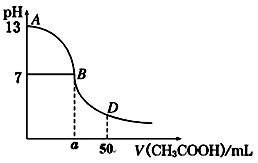
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间.(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)________2c(Na+)。(填“>”、“<”或“=”)
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:
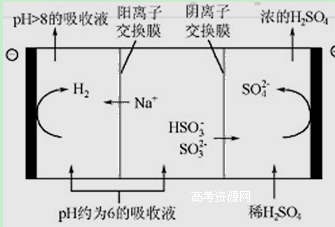
① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
 H++A2-。
H++A2-。 H++HA-,HA-
H++HA-,HA-