题目内容
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。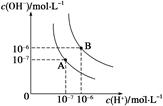
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)1×10-11、 < 、 促进 (2) 2 、 5% (3)NaCN+H2O+CO2=HCN+NaHCO3
解析试题分析:(1)由图中曲线可知,25℃时水的离子积Kw = c(H+) × c(OH-)=10-14 ,95℃时水的离子积Kw = c(H+) × c(OH-)=10-12 ,Kw(25 ℃)> Kw(95℃),且95℃的氢氧化钠溶液中,当c(OH-)="0.1" mol·L-1 时,由水电离的c(H+) =10-12 /0.1 mol·L-1 =10-11 ;往水中加水解的盐,将促进水的电离。
(2)因为HA为一元酸,所以有0.001molHA电离,则C(H+)="0.001mol÷0.1L=0.01" mol/L,所以pH=-lgC(H+)=2,电离度α=n电离/n总="0.001" mol÷(0.1L×0.2 mol/L) ×100%=5%。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量,所以酸的电离常数越大,则说明该酸酸性越强。所以从右表数据可知,酸性比较:H2CO3 >HCN>HCO3- ,所以根据强酸制弱酸原理,往NaCN溶液中通入少量CO2 发生的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3 。
考点:本题主要考查的是水的离子积常数的影响因素。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案某学生欲用已知物质的量浓度的醋酸来测定未知物质的量浓度的氢氧化钠溶液时,选择适当的指示剂。请填写下列空白:
(1)用标准醋酸滴定待测的氢氧化钠溶液时,从下列选项中选出最恰当的一项________。
| | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
滴定时应左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到加入一滴醋酸后,溶液颜色由 色变为 色,并在半分钟内溶液颜色不改变为止。
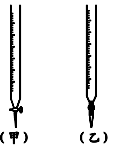
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的是 。
A.酸式滴定管未用标准醋酸润洗就直接注入标准醋酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取醋酸体积时,开始仰视读数,滴定结束后俯视读数
(3)某学生根据3次实验分别记录有关数据如表:
| | 待测氢氧化钠 | 0.100mol/L醋酸的体积 | |
| 滴定次数 | 溶液的体积(ml) | 滴定前的刻度(ml) | 滴定后的刻度(ml) |
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
依据上表数据计算该氢氧化钠溶液的物质的量浓度为 。
(4)下图为上述25 mL NaOH溶液中逐滴滴加CH3COOH溶液过程中溶液pH的变化曲线,请回答:
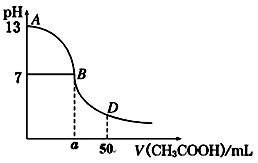
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间.(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)________2c(Na+)。(填“>”、“<”或“=”)
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同) _
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是_ _
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_ 作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_ 。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_ 0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp(mol2·L-2) | 3×10-9 | 9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④向沉淀中加入足量的盐酸。
(1)步骤①所得悬浊液中[Ca2+]=________ mol·L-1
(2)写出第②步发生反应的离子方程式:________________________________.
(3)设计第③步的目的是________________________________________________.
(4)第④步操作发生的现象为: 。
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10–9 | 6.8×10–6 | 5.5×10–6 | 1.8×10–11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 (填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 (用离子方程式表示)。
(3)已知海水中镁离子浓度为1.8×10–3mol·L–1,则要使镁离子产生沉淀,溶液的PH最低应为 。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析, HA是强酸还是弱酸 。
(2)②组情况表明,c 0.2 (选填“>”、“<”或 “=”)。混合液中离子浓度c(A-) __c(Na+)
(选填“>”、“<”或 “=”)。
(3) 从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (选填“>”、“<”或 “=”),该混合溶液中离子浓度由大到小的顺序是 。
(4)①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)= mol·L-1; c(OH-)-c(HA)= mol·L-1