题目内容
【题目】硼镁泥是一种工业废料,主要成分是MgO(MgO占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
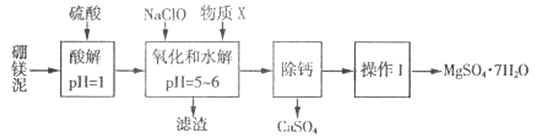
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800 mL,若用18.4 mol/L的浓硫酸来配制,则量取浓硫酸时,需使用的量筒规格为_______。(填字母)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)加入的NaClO 可与酸解液中Mn2+ 反应:Mn2+ + ClO-+H2O= MnO2 ↓+ 2H+ + Cl-,溶液中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________。该步骤中,物质X是________(填化学式)。
(3)“滤渣”中除MnO2、CaSO4 外还有_______。(填化学式)
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 | |
溶解度/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤:____________。
(5)“操作I”是将滤液经过一系列操作后真空干燥,采用“真空干燥”的原因是________。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O 为147.6 g,则MgSO4·7H2O的产率为________%。
【答案】 D 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O MgO[或MgCO3或Mg(OH)2或其他合理答案] Fe(OH)3、Al(OH)3、SiO2 蒸发浓缩、趁热过滤 减小压强,降低水的沸点,避免干燥溫度过高而使晶体失去结晶水 60(答60%不给分)
【解析】(1)稀释前后溶质的物质的量不变,1mol/L×800ml=18.4mol/L×V(浓硫酸),V(浓硫酸)=43.5ml,故选择的量筒的规格应为100ml,答案选D。
(2)FeO溶于酸中生成有还原性的Fe2+,能与ClO-发生氧化还原反应,离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;氧化和水解步骤中加入X的目的是将Fe3+和Al3+转化为沉淀,故可加入. MgO[或MgCO3或Mg(OH)2等不溶物,中和酸性,促进Fe3+ 和Al3+的水解正向进行生成沉淀而除去,故X为MgO[或MgCO3或Mg(OH)2或其他合理答案]。
(3)CaSO4微溶于水,Mn2+转化为MnO2,SiO2不溶于水,Fe3+和Al3+完全水解得到Fe(OH)3和Al(OH)3沉淀,故滤渣中除MnO2、CaSO4外还有:SiO2、Fe(OH)3、Al(OH)3。
(4) MgSO4的溶解度随温度的升高而增大,CaSO4的溶解度随温度的升高而降低,将MgSO4和CaSO4混合溶液加热蒸发浓缩,CaSO4近乎沉淀完,然后在较高温度下过滤而除去CaSO4,在较高温度下过滤可以防止温度降低时CaSO4溶解度增大,故答案为:蒸发浓缩,趁热过滤。
(5)压强低液体的沸点就低,降低压强,可以降低水的沸点,从而可以在较低的温度下干燥晶体,避免温度高而使晶体失去部分结晶水。
(6)Mg2+的物质的量为100g×40%÷40g·mol-1=1mol,所以理论上MgSO4·7H2O的质量为1mol×246g/mol=246g,故MgSO4·7H2O的产率为147.6g÷246g×100%=60%。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)已知:反应后溶液的比热容c为4.18J℃﹣1g﹣1 , 0.5molL﹣1盐酸和0.55molL﹣1NaOH溶液的密度均为1gcm﹣3 . 实验时记录的实验数据如表:
实验 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=(保留两位小数)
②已知:CH3COOH(aq)CH3COO﹣(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH﹣(aq)=CH3COO﹣(aq)+H20(l)△H3 则△H3△H1(填“>”、“<”、“=”)