题目内容
【题目】镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+NH3(g)=GaN(s)+3HCl(g) H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g)H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3
由上述反应可知H3=_____________。
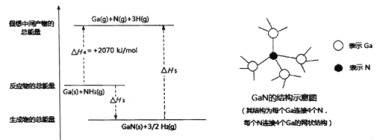
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____molGa-N键,拆开lmolGa-N键所需能量为______kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
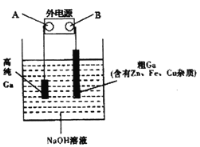
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____极,电解精炼镓时产生阳极泥的主要成分是___________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________。(η=生成目标产物消耗的电子数÷转移的电子总数)。
【答案】 ![]() Ga2O3+2OH-=2 GaO2-+H2O -66kJ/mol 4 370.5 负 Fe、Cu GaO2-+3e-+2H2O =Ga+ 4OH- 75%
Ga2O3+2OH-=2 GaO2-+H2O -66kJ/mol 4 370.5 负 Fe、Cu GaO2-+3e-+2H2O =Ga+ 4OH- 75%
【解析】(1)Ga位于周期表的第四周期,ⅢA族画出原子结构示意图;
(2)Ga2O3溶解在NaOH溶液中的反应类似于Al2O3在氢氧化钠溶液中的反应;
(3)根据盖斯定律进行计算;根据题干图示进行判断;
(4)①根据电解池原理进行判断电源的正负极,根据金属放电顺序判断阳极泥的成分;
②根据电解池原理写出阴极的电极反应式;
③根据得失电子守恒进行计算,确定电解效率。
(1)Ga位于周期表的第四周期,ⅢA族,所以其有4个电子层,核电荷数是31,原子结构示意图:![]() ,正确答案:
,正确答案:![]() ;
;
(2)Ga2O3溶解在NaOH溶液的反应类似于Al2O3在氢氧化钠溶液中的反应,Ga2O3在NaOH溶液主要存在GaO2-离子,所以其反应的离子方程式:Ga2O3+2OH-=2 GaO2-+H2O,正确答案:Ga2O3+2OH-=2 GaO2-+H2O;
(3)根据盖斯定律,将H3=[①×2+②]÷2=-66KJ/mol;根据图示分析,1molGaN含有4molGa-N键;
Ga(s)+NH3(g)=Ga(g)+3H(g)+N(g) H4=+2070KJ/mol,
Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3=-66KJ/mol
H2(g)=2H(g) H5=+436kJ/mol
根据盖斯定律得:GaN(s)= Ga(g)+ N(g)H6=+1482KJ/mol,所以拆开lmolGa-N键所需能量为1482KJ/4=370.5kJ,正确答案:-66kJ/mol;4;370.5;
(4)①根据图示:与电源A相连的是高纯度Ga,高纯度Ga应该在阴极,所以A级是电源的负极;根据金属的活动性Zn>Ga>Fe>Cu,Fe、Cu在阳极不能够失去电子,所以阳极泥主要成分是Fe、Cu,正确答案:负极;Fe、Cu;
②阳极Ga溶于氢氧化钠溶液生成GaO2-,GaO2-离子迁移到达阴极并在阴极放电析出高纯镓,阴极的电极反应GaO2-+3e-+2H2O =Ga+ 4OH-,正确答案:GaO2-+3e-+2H2O =Ga+ 4OH-;
③外电路通过0.4mole-时,根据阴极的电极反应GaO2-+3e-+2H2O =Ga+ 4OH-可知,阴极析出7.0gGa,转移的电子的物质的量:n(e-)=3×7g÷69.7g/mol=0.3mol,所以该电解装置的电解效率η=0.3mol÷0.4mol×100%=75%,正确答案:75%。

 名校课堂系列答案
名校课堂系列答案【题目】硼镁泥是一种工业废料,主要成分是MgO(MgO占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
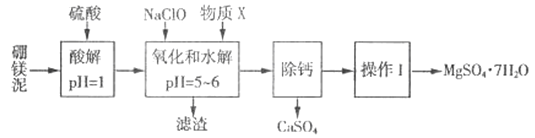
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800 mL,若用18.4 mol/L的浓硫酸来配制,则量取浓硫酸时,需使用的量筒规格为_______。(填字母)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)加入的NaClO 可与酸解液中Mn2+ 反应:Mn2+ + ClO-+H2O= MnO2 ↓+ 2H+ + Cl-,溶液中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________。该步骤中,物质X是________(填化学式)。
(3)“滤渣”中除MnO2、CaSO4 外还有_______。(填化学式)
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 | |
溶解度/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤:____________。
(5)“操作I”是将滤液经过一系列操作后真空干燥,采用“真空干燥”的原因是________。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O 为147.6 g,则MgSO4·7H2O的产率为________%。
【题目】氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)![]() CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与![]() 的关系如图所示。
的关系如图所示。
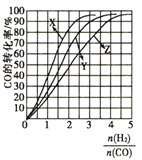
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得![]() =
=![]() ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。