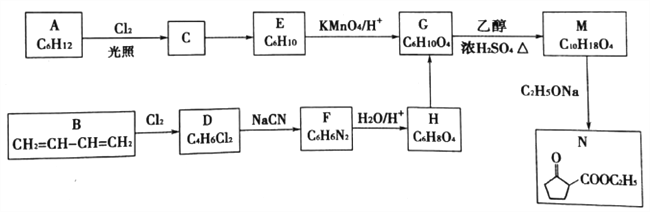
题目内容
【题目】某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)已知:反应后溶液的比热容c为4.18J℃﹣1g﹣1 , 0.5molL﹣1盐酸和0.55molL﹣1NaOH溶液的密度均为1gcm﹣3 . 实验时记录的实验数据如表:
实验 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=(保留两位小数)
②已知:CH3COOH(aq)CH3COO﹣(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH﹣(aq)=CH3COO﹣(aq)+H20(l)△H3 则△H3△H1(填“>”、“<”、“=”)
【答案】
(1)量筒、温度计
(2)﹣56.8kJ?mol﹣1;>
【解析】解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少量筒、温度计;
所以答案是:量筒、温度计;(2)①第1次反应前后温度差为:3.3℃,第2次反应前后温度差为:3.5℃,平均温度差为3.4℃,50mL0.55molL﹣1NaOH溶液与50mL0.5molL﹣1HCl溶液混合,氢氧化钠过量,反应生成了0.025mol水,50mL0.5molL﹣1 盐酸、0.55molL﹣1NaOH溶液的质量和为:m=100mL×1g/mL=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为1.4212kJ× ![]() =﹣56.8kJ,即该实验测得的中和热△H=﹣56.8kJmol﹣1;
=﹣56.8kJ,即该实验测得的中和热△H=﹣56.8kJmol﹣1;
所以答案是:﹣56.8kJmol﹣1;
②醋酸电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量偏小,但△H偏大;
所以答案是:>.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是________反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______。
③实验2达到平衡时,a_______7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____(填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________。
【题目】硼镁泥是一种工业废料,主要成分是MgO(MgO占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
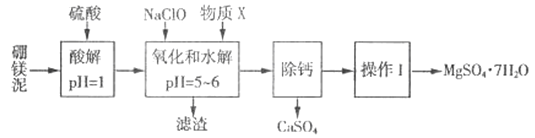
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800 mL,若用18.4 mol/L的浓硫酸来配制,则量取浓硫酸时,需使用的量筒规格为_______。(填字母)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)加入的NaClO 可与酸解液中Mn2+ 反应:Mn2+ + ClO-+H2O= MnO2 ↓+ 2H+ + Cl-,溶液中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________。该步骤中,物质X是________(填化学式)。
(3)“滤渣”中除MnO2、CaSO4 外还有_______。(填化学式)
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 | |
溶解度/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤:____________。
(5)“操作I”是将滤液经过一系列操作后真空干燥,采用“真空干燥”的原因是________。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O 为147.6 g,则MgSO4·7H2O的产率为________%。