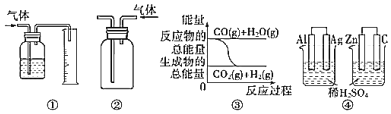
题目内容
【题目】某温度时,在2L的恒容密闭容器中,X、Y、Z三种无色气体的物质的量随时间的变化曲线如图所示。
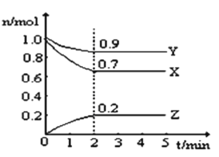
(1)起始时X的浓度为c(X)=_______;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0-2分钟内的平均反应速率为v(Z)=___________。
(2)由图中所给数据进行分析,该反应的化学方程式为___________。
(3)能说明该反应已达到平衡状态的是___________
A.![]() (X)=3
(X)=3![]() (Y)
(Y)
B.容器内气体密度不变
C.2![]() 逆(X)=3
逆(X)=3![]() 正(Z)
正(Z)
D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
F.容器内气体颜色不再发生变化
【答案】0.5mol/L 10% 0.05mol/(L·min) 3X+Y![]() 2Z CE
2Z CE
【解析】
(1)从图中可知,起始时X的物质的量为1mol,故浓度为c(X)=![]() ;反应从开始至2分钟末,Y反应了0.1mol,故其转化率为α(Y)=
;反应从开始至2分钟末,Y反应了0.1mol,故其转化率为α(Y)=![]() ;0-2分钟内Z的物质的量从0变化为0.2mol,故用Z的浓度变化表示0-2分钟内的平均反应速率为
;0-2分钟内Z的物质的量从0变化为0.2mol,故用Z的浓度变化表示0-2分钟内的平均反应速率为![]() ,故答案为:0.5mol/L 10% 0.05mol/(L·min);
,故答案为:0.5mol/L 10% 0.05mol/(L·min);
(2)由图中可知2min内X减少了0.3mol,Y减少了0.1mol,而Z增加了0.2mol,故X、Y为反应物,Z为生成物,物质的量之比等于化学计量数之比,故该反应的化学方程式为3X+Y![]() 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y![]() 2Z;
2Z;
(3)A.![]() (X)=3
(X)=3![]() (Y),未指明正、逆反应速率,故不能说明达到化学平衡,A不符合题意;
(Y),未指明正、逆反应速率,故不能说明达到化学平衡,A不符合题意;
B.X、Y、Z均为气态,故容器内气体密度在反应过程中始终没有改变,故不能说明达到化学平衡,B不符合题意;
C.根据反应速率之比等于化学计量系数之比有2![]() 正(X)=3
正(X)=3![]() 正(Z),又2
正(Z),又2![]() 逆(X)=3
逆(X)=3![]() 正(Z),推出
正(Z),推出![]() 正(X)=
正(X)=![]() 逆(X)=
逆(X)=![]()
![]() 正(Z),故说明反应达到平衡状态,C符合题意;
正(Z),故说明反应达到平衡状态,C符合题意;
D.平衡的标志是各组分的物质的量不再改变,而不是相等,D不符合题意;
E.混合气体的平均相对分子质量等于总质量除以总的物质的量,由于反应3X+Y![]() 2Z反应前后的气体系数不等,故反应过程中混合气体的平均相对分子质量一直在改变,现在不再改变的状态即为反应的平衡状态,E符合题意;
2Z反应前后的气体系数不等,故反应过程中混合气体的平均相对分子质量一直在改变,现在不再改变的状态即为反应的平衡状态,E符合题意;
F.根据题干已知X、Y、Z均为无色气体,故容器内气体颜色一直未发生变化,故容器颜色不变不能说明反应达到平衡状态,F不符合题意;
故答案为:CE。