题目内容
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
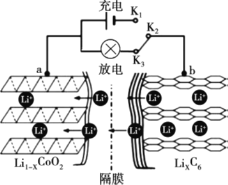
① 放电时,电子的流动方向为______。(用a、b、K2、K3)
② 放电时,正极的电极反应式为______。
(2)钴酸锂回收再生流程如下:
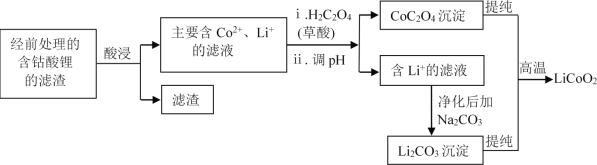
① 用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
② 用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸。主要原因是:
ⅰ.会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
ⅱ.Cl-对建筑材料的腐蚀及带来的水体问题等。
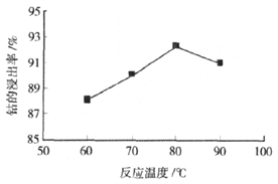
③ 其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释随着温度升高,钴的浸出率先升高后降低的原因:______。
④ 已知草酸为二元弱酸,应用化学平衡移动原理,结合化学用语解释CoC2O4沉淀的同时溶液酸性增强的原因:______。
⑤ 高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
【答案】b → K2 →K3 → a Li1-xCoO2 +xLi+ +xe-= LiCoO2 还原LiCoO2(将LiCoO2中的+3价Co还原为Co2+) 2LiCoO2 +8HCl= 2LiCl+2CoCl2 + Cl2↑+4H2O 80℃之前,升高温度,反应速率加快,所以浸出率增大;80℃后,升高温度使H2O2分解速率加快,H2O2浓度下降,使浸出率反而降低 草酸溶液中存在电离平衡:H2C2O4![]() H++HC2O4- ,HC2O4-
H++HC2O4- ,HC2O4- ![]() H++C2O42-,溶液中Co2+与C2O42-反应生成CoC2O4,使c(C2O42-)减小,促进电离平衡正向移动,所以c(H+)增大 4CoC2O4+2Li2CO3+3O2 高温 4LiCoO2 +10CO2
H++C2O42-,溶液中Co2+与C2O42-反应生成CoC2O4,使c(C2O42-)减小,促进电离平衡正向移动,所以c(H+)增大 4CoC2O4+2Li2CO3+3O2 高温 4LiCoO2 +10CO2
【解析】
(1)考察原电池的原理,题中已经告知放电过程的原理示意图,Li+在原电池内部由b向a移动,则电子在外电路由b向a移动,也由此可以推出右侧的电极为负极,左侧的电极为正极;
(2)考察工业流程。①观察酸浸前后,Co的化合价由+3变为了+2,则Co的化合物作氧化剂,由于H2SO4还原性很弱,所以H2O2作还原剂;
②HCl具有还原性,而在①中我们得知Co(III)具有氧化性,所以可以得出这两种物质可以发生氧化还原反应;
③温度升高,影响的是化学反应速率,浸出率随温度的升高而升高,是因为反应速率增大;而H2O2本身的热稳定性不高,超过80℃,H2O2的分解速率大于被氧化的速率,使得浸出的反应速率受到影响,从而降低了浸出率;
④草酸溶液中有:H2C2O4![]() H++HC2O4- ,HC2O4-
H++HC2O4- ,HC2O4- ![]() H++C2O42-,Co2+与C2O42-结合成沉淀,会使溶液中C2O42-的浓度降低,两个平衡正向移动,使得溶液的H+浓度增大;
H++C2O42-,Co2+与C2O42-结合成沉淀,会使溶液中C2O42-的浓度降低,两个平衡正向移动,使得溶液的H+浓度增大;
⑤题中已经告知了反应物和生成物,配平方程式即可。
(1)①放电过程,K2、K3连接形成原电池,导线为外接电路,Li+的流动方向是从电池内部b→a移动,电子的移动方向与正电荷相反,则电子流动的方向为b→K2→K3→a;
②如图所示,放电时,Li+从LixC6一侧流向Li1-xCoO6一侧,则正极的电极反应为:Li1-xCoO2 +xLi+ +xe-= LiCoO2;
(2)①LiCoO2中,Co呈+3价,滤液中的Co呈+2价,则Co化合物被还原了,H2SO4还原性很弱,所以H2O2在该过程中起还原剂的作用,将LiCoO2还原;
②盐酸具有还原性,Co(III)具有氧化性,二者会发生反应生成Cl2:2LiCoO2+8HCl= 2LiCl+2CoCl2 + Cl2↑+4H2O;
③在80℃之前,浸出率随温度的升高而升高,是因为温度升高,反应速率增大; 80℃之后,H2O2的分解速率大于H2O2被氧化的速率,使得浸出率下降;
④草酸溶液中有:H2C2O4![]() H++HC2O4- ,HC2O4-
H++HC2O4- ,HC2O4- ![]() H++C2O42-,Co2+与C2O42-结合成沉淀,会使溶液中C2O42-的浓度降低,平衡向右移动,使得溶液中H+的浓度增大,溶液的酸性增强;
H++C2O42-,Co2+与C2O42-结合成沉淀,会使溶液中C2O42-的浓度降低,平衡向右移动,使得溶液中H+的浓度增大,溶液的酸性增强;
⑤题中告知了反应物和生成物,则化学方程式为:4CoC2O4+2Li2CO3+3O2 高温 4LiCoO2 +10CO2。

【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
选项 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br>I |
A. A B. B C. C D. D
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液,量取10.00mL食用白醋,注入烧杯中用水稀释后转移到_____(填仪器名称)中定容,摇匀即得;
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂;
(3)读取盛装0.1000mol/L NaOH溶液的______(填仪器名称)的初始读数,如果液面位置如下图所示,则此时的读数为______mL。
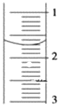
(4)滴定,当__________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(5)经计算,市售白醋总酸量=_______g/100mL (醋酸的式量=60)。
(6)在本实验过程中,下列操作会使实验结果偏大的是______(填写序号)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定剧烈摇动,有少量液体溅出
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度