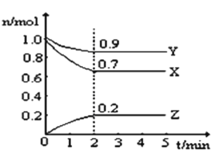
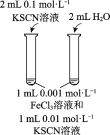
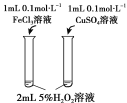
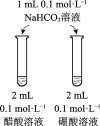
题目内容
【题目】25℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法不正确的是

A. HX为弱酸
B. V1 <20
C. M点溶液中离子浓度由大到小的顺序为:c(X-)>c(Na+)>c(H+)>c(OH-)
D. 二者等体积混合时,c(Na+)=c(X-) + c(OH-)
【答案】D
【解析】
若HX为强酸,其浓度为0.1 mol·L-1时,溶液的pH应该为1,但实际上pH为3,则说明HX为弱酸,可从此进行分析作答。
A. 起始时,HX的浓度为0.1 mol·L-1,pH=3,则说明HX为弱酸,A正确;
B. 若V1=20,则溶液的溶质只有NaX,由于HX为弱酸,则NaX溶液呈碱性,pH>7,所以V1应小于20,B正确;
C. M点的溶质是等浓度的HX和NaX,溶液呈酸性,说明HX的电离程度大于X-的水解程度,则溶液中离子浓度大小顺序为:c(X-)>c(Na+)>c(H+)>c(OH-),C正确;
D. 两种溶液等体积混合时,根据电荷守恒有:c(Na+)+c(H+)=c(X-) + c(OH-),D错误;
故合理选项为D。

【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7