题目内容
8.今含有a:CH3COOH、b:HCl、c:H2SO4三种溶液.(1)当它们的pH相同时,其物质的量浓度的关系是c<b<a
(2)当它们的物质的量浓度相同时,其pH关系是a>b>c
(3)中和同一烧碱溶液,需同浓度的三种溶液的体积关系是c<a=b
(4)体积、浓度相同的a、b、c三溶液,分别与同浓度的NaOH溶液反应使pH等于7,所需NaOH溶液的体积关系是c>b>a.
分析 (1)pH=-lgc(H+),浓度相同,溶液pH大小由溶液中氢离子浓度大小分析计算判断;
(2)pH相同溶液中氢离子浓度相同,依据醋酸是弱酸,硫酸是二元酸分析判断;
(3)中和等量氢氧化钠,依据化学方程式中的计量数关系计算判断;
(4)溶液中溶质物质的量相同时,与碱反应后溶液呈中性,硫酸是二元酸,醋酸是弱酸.
解答 解:(1)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L,需要氯化氢溶液浓度为1mol/L,需要H2SO4 溶液浓度为0.5mol/L;其物质的量浓度由大到小排列的是:c<b<a,
故答案为:c<b<a;
(2)当它们的物质的量浓度相同时,CH3COOH是弱酸部分电离,氢离子浓度最小;HCl是强酸完全电离,电离的氢离子大于醋酸;H2SO4是二元强酸,电离的氢离子浓度大于氯化氢,根据pH=-lgc(H+)可知,氢离子浓度越小,pH越大,则溶液的pH:a>b>c,
故答案为:a>b>c;
(3)中和相同体积、相同物质的量浓度的烧碱溶液,假设氢氧化钠物质的量为1mol,需要醋酸1mol,需要HCl 1mol;需要H2SO4 0.5mol;需相同物质的量浓度的三种酸溶液的体积大小关系为:c<a=b,
故答案为:c<a=b;
(4)体积和浓度相同的三溶液,假设溶质为1mol,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,CH3COOH是弱酸,恰好中和生成醋酸钠溶液呈碱性,所以需要烧碱小于1mol;氯化氢和1mol氢氧化钠恰好反应溶液呈中性;1molH2SO4和2mol恰好反应需要氢氧化钠2mol; 所需烧碱溶液的体积由大到小关系为:c>b>a,
故答案为:c>b>a.
点评 本题考查了酸碱反应中溶液性质及溶液pH计算,题目难度中等,注意醋酸为弱电解质溶液中部分电离、硫酸为二元强酸、盐酸为一元强酸,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C3H6 |
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③④ | D. | 全部 |
| A. | 易溶于水的电解质一定是强电解质,难溶于水的电解质一定是弱电解质 | |
| B. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| C. | NaCl溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 氯化钠晶体不导电是由于氯化钠晶体中不存在自由移动的离子 |
| A. | 通常状况下,氨的溶解度不大 | B. | 氨水中的NH3•H2O电离出少量OH- | ||
| C. | 溶于水的氨分子只有少量电离 | D. | 氨本身的弱碱性 |
| A. | Na2O2分子中所有原子最外层均达到8电子稳定结构 | |
| B. | NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 | |
| C. | 同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物 | |
| D. | NH4Cl仅由非金属元素组成,所以它是共价化合物 |
| A. | 银氨溶液 | B. | 新制Cu(OH)2悬浊液 | C. | KMnO4(H+)溶液 | D. | NaOH溶液 |
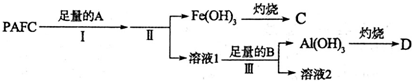
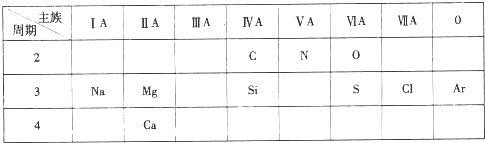
 ;
;