题目内容
【题目】为配制480mL0.1mol·L-1Na2SO4溶液。回答下列问题。
(1)配制Na2SO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、___、___。
(2)用托盘天平称十水硫酸钠(Na2SO4·10H2O)晶体__g。
(3)下列操作对所配溶液的浓度有何影响(填“偏高、偏低或无影响”)
A.误用“左码右物”的称量方法称该晶体___
B.容量瓶未经干燥即使用___
C.溶解后没有冷却便进行定容___
D.忘记将洗涤液转入容量瓶___
E.定容时俯视刻度线定容___
【答案】胶头滴管 500mL容量瓶 16.1 偏低 无影响 偏高 偏低 偏高
【解析】
(1)依据配制步骤选择仪器;
(1)依据配制溶液体积选择合适规格容量瓶,依据m=cVM计算溶质的质量;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)配制一定物质量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以用到的仪器:天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,缺少的仪器:胶头滴管、500ml 容量瓶;
(2)配制480mL0.1molL-1Na2SO4溶液,应选择500mL容量瓶,需要溶质的质量为:0.1mol/L×0.5L×322g/mol=16.1g;
(3)A.误用“左码右物”的称量方法称该晶体,导致溶质的物质的量偏小,溶液浓度偏低;
B.容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量和溶液体积都不产生影响,溶液浓度无影响;
C.溶解后没有冷却便进行定容,冷却后溶液体积偏小,溶液浓度偏高;
D.忘记将洗涤液转入容量瓶,导致溶质的物质的量偏小,溶液浓度偏低;
E.俯视刻度线定容,导致溶液体积偏小,溶液浓度偏高。

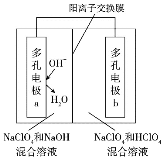
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu+H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
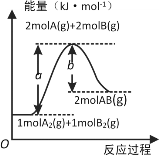
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H=﹣169kJmol﹣1
O2(g)=Cu2O(s);△H=﹣169kJmol﹣1
②C(s)+![]() O2(g)=CO(g);△H=﹣110.5kJmol﹣1
O2(g)=CO(g);△H=﹣110.5kJmol﹣1
③Cu(s)+![]() O2(g)=CuO(s);△H=﹣157kJmol﹣1
O2(g)=CuO(s);△H=﹣157kJmol﹣1
则方法a发生的热化学方程式是:_____。
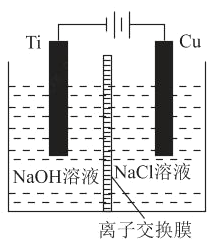
(2)方法c采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为_____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值_____(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为_____。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
2H2O(g)![]() 2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
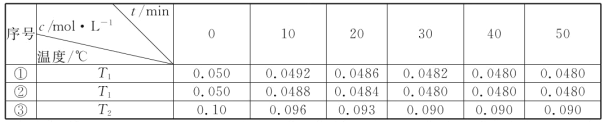
①对比实验的温度:T2_____T1(填“>”“<”或“=”),能否通过对比实验①③到达平衡所需时间长短判断:_____(填“能”或“否”)。
②实验①前20min的平均反应速率 v(O2)=_____
③催化剂的催化效率:实验①_____实验②(填“>”或“<”)。