题目内容
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述正确的是
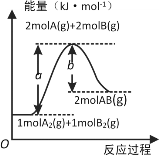
A. 形成2molA-B键,吸收b kJ能量
B. 每生成2分子AB吸收bkJ热量
C. 反应物的总能量低于生成物的总能量
D. 该反应热ΔH=(b-a)kJ·mol-1
【答案】C
【解析】
观察题给图像可以得到上述反应的反应物总能量低于生成物总能量为吸热反应;化学反应过程中化学键断裂为吸热过程,化学键形成为放热过程。
A. 化学键形成为放热过程,所以形成2molA-B键,放出b kJ能量,故A错误;
B. 该反应吸热,每生成2mol AB吸收(a-b) kJ热量,故B错误;
C. 根据图像,反应物的总能量低于生成物的总能量,故C正确;
D. 该反应吸热,焓变为正值,该反应热ΔH=+(a-b)kJ·mol-1,故D错误。

【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
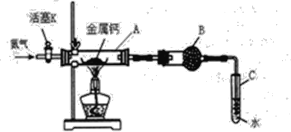
(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。

