题目内容
有A、B、C、D四种溶液,它们是烧碱、硫酸、碳酸氢铵、氯化铜溶液中的某一种。各取少量,将其两两混合,其中A、B混合有蓝色絮状沉淀生成, C 与足量B或D混合均有无色气体产生。根据题意回答下列问题:
(1)B、C分别是 、
(2)向A中滴加B,离子方程式:
向C中滴加D,离子方程式:
(3)少量B和C混合,现象:________,离子方程式:_______________________________。
(4)上述三个反应均属于________________反应(填基本反应类型),反应发生的条件的不同点是 ;相同点是 。
(1)NaOH NH4HCO3
(2)Cu2++2OH-=Cu(OH)2↓ HCO3-+H+=CO2↑+H2O
(3)无明显现象 HCO3-+OH-=H2O+ CO32-
(4)复分解 第一个生成沉淀,第二个生成气体和H2O,第三个生成H2O 都使溶液中的离子浓度减小
解析试题分析: C 与足量B或D混合均有无色气体产生,说明C为碳酸氢铵,A、B混合有蓝色絮状沉淀生成,A、B其中一个为氯化铜,一个为烧碱。综合分析可知B为烧碱(NaOH),D为硫酸。故A中滴加B:Cu2++2OH-=Cu(OH)2↓。C中滴加D:HCO3-+H+=CO2↑+H2O。少量NaOH和NH4HCO3混合时HCO3-+OH-=H2O+ CO32-。三个反应均属于复分解反应,第一个生成沉淀,第二个生成气体和H2O,第三个生成H2O,但都使溶液中的离子浓度减小。
考点:离子反应

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);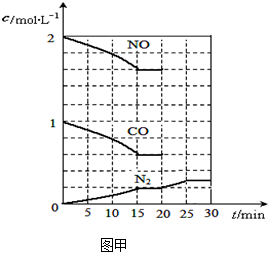
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
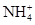 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、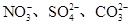 。已知:
。已知: