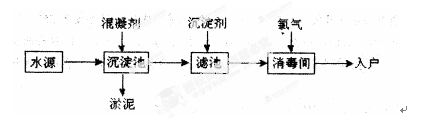
题目内容
某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:______________________________________________。
(2)实验②的化学反应中转移电子的物质的量是________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是________
(每空2分,共6分)
(1)ClO-+2I-+2H+== I2+Cl-+H2O
(2)0.004 mol
(3)ClO-> I2> SO42-
解析试题分析:(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,
设转移电子的物质的量为x.
H2O+SO32-+I2=SO42-+2I-+2H+转移电子
1mol 2mol
0.5mol·L-1×0.004L x
x=0.5mol·L-1×0.004L×2mol/1mol
=0.004mol,
答:转移电子的物质的量是0.004 mol;
(3)实验①说明氧化性强弱为:ClO->I2,实验②说明氧化性强弱为:I2>SO42-,所以在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-,答案为:SO42-、I2、ClO-.
考点 :性质实验方案的设计;氧化性、还原性强弱的比较

二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);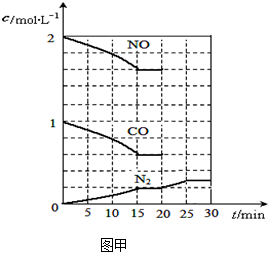
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。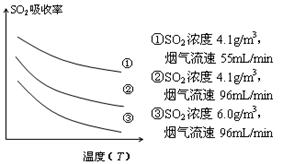
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为( )
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式正确的是 ( )
| A.5H218O2+2KMnO4+3H2SO4===518O2↑+K2SO4+2MnSO4+8H2O |
| B.CH3COOH+C2H518OH→CH3COOCH2CH3+H218O |
| C.2Na2O2+2H218O===4NaOH+18O2↑ |
| D.K37ClO3+6HCl===K37Cl+3Cl2↑+3H2O |