题目内容
【题目】写出下列反应的化学方程式。
(1)AlCl3水解溶液呈酸性________
(2)将TiCl4加入热水中生成TiO2.xH2O________
(3)向Na2S2O3溶液中加入稀硫酸__________
(4)在Mg(OH)2悬浊液中加入NH4Cl溶液,沉淀溶解___________
【答案】 AlCl3+ 3H2O ![]() Al(OH)3 + 3HCl TiCl4 + (x+2)H2O
Al(OH)3 + 3HCl TiCl4 + (x+2)H2O![]() TiO2﹒xH2O↓+ 4HCl Na2S2O3 + H2SO4
TiO2﹒xH2O↓+ 4HCl Na2S2O3 + H2SO4![]() Na2SO4 + S↓+ SO2↑+ H2O Mg(OH)2(s) + 2NH4Cl(aq)
Na2SO4 + S↓+ SO2↑+ H2O Mg(OH)2(s) + 2NH4Cl(aq) ![]() MgCl2 (aq) + 2NH3﹒H2O(aq)
MgCl2 (aq) + 2NH3﹒H2O(aq)
【解析】⑴.AlCl3水解使溶液呈酸性,水解反应的化学方程式为AlCl3+ 3H2O ![]() Al(OH)3 + 3HCl,故答案为:AlCl3+ 3H2O
Al(OH)3 + 3HCl,故答案为:AlCl3+ 3H2O ![]() Al(OH)3 + 3HCl;
Al(OH)3 + 3HCl;
⑵. 将TiCl4加入热水中发生水解反应生成TiO2.xH2O和HCl,化学方程式为TiCl4 + (x+2)H2O![]() TiO2﹒xH2O↓+ 4HCl,故答案为:TiCl4 + (x+2)H2O
TiO2﹒xH2O↓+ 4HCl,故答案为:TiCl4 + (x+2)H2O![]() TiO2﹒xH2O↓+ 4HCl;
TiO2﹒xH2O↓+ 4HCl;
⑶. 向Na2S2O3溶液中加入稀硫酸,二者发生反应生成硫酸钠、硫、二氧化硫和水,化学方程式为Na2S2O3 + H2SO4![]() Na2SO4 + S↓+ SO2↑+ H2O,故答案为:Na2S2O3 + H2SO4
Na2SO4 + S↓+ SO2↑+ H2O,故答案为:Na2S2O3 + H2SO4![]() Na2SO4 + S↓+ SO2↑+ H2O;
Na2SO4 + S↓+ SO2↑+ H2O;
⑷. 在Mg(OH)2悬浊液中加入NH4Cl溶液,NH4+与OH-结合生成NH3·H2O,使Mg(OH)2的溶解平衡正向移动,Mg(OH)2溶解,化学方程式为Mg(OH)2(s) + 2NH4Cl(aq) ![]() MgCl2 (aq) + 2NH3﹒H2O(aq),故答案为:Mg(OH)2(s) + 2NH4Cl(aq)
MgCl2 (aq) + 2NH3﹒H2O(aq),故答案为:Mg(OH)2(s) + 2NH4Cl(aq) ![]() MgCl2 (aq) + 2NH3﹒H2O(aq);
MgCl2 (aq) + 2NH3﹒H2O(aq);

 阅读快车系列答案
阅读快车系列答案【题目】为了探究氨气及氨水的还原性,某兴趣小组同学设计了以下探究活动。
I.探究氨气的还原性
该兴趣小组同学利用以下装置(夹持,加热仪器略)探究氯气与氨气的反应,其中A、F分别为氯气和氨气的发生装置,B为纯净干燥的氯气与氨气反应的装置。
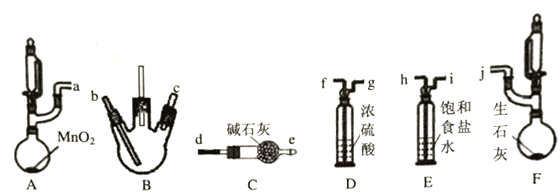
请回答下列问题:
(1)上述装置接口的连接顺序为a接h、i接f、g接___、____接___、____接j,其中装置D的作用是____________。
(2)若氨气足量,装置B中出现的现象为____________。
II.探究氨水的还原性
该兴趣小组同学探究不同条件下高锰酸钾溶液与氨水的反应,实验如下:
实验 | 操作 | 现象 |
① | 取2mL.0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
② | 取2mL0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约2min后溶液紫红色完全退去 |
③ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封ImL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
④ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加人半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约5min后溶液紫红色完全退去 |
(3)实验①中氧化产物为N2,写出该反应的离子方程式:_________。
(4)实验①②说明________________。
(5)实验②比实验④反应速率_____(填“快“或“慢”),原因是_________。
(6)1:5的硫酸溶液(密度为ρ2g·cm-3),可用质量分数为98%的浓硫酸(密度为ρ1g·cm-3)和
蒸馏水按体积比1:5配成,则该1:5的硫酸溶液的物质的量浓度为_____mol/L。(用含ρ1、ρ2的式子表示)
(7)由实验I、II可得出的结论是____________________。