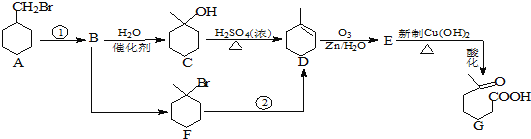
题目内容
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。


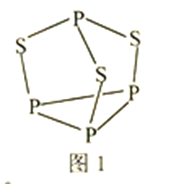
(1)在一定浓度的![]() 溶液中,钴的浸出率随时间、温度的变化如图1所示
溶液中,钴的浸出率随时间、温度的变化如图1所示![]() 考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______
考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______![]()
(2)请配平下列除铁的化学方程式:____________
_ _Fe2(SO4)3+ H2O + Na2CO3 == Na2Fe6(SO4)4(OH)12↓+ Na2SO4 + CO2↑
(3) “除钙、镁”的原理反应为:![]() ;
;![]() 已知
已知![]() ,加入过量NaF溶液反应完全后过滤,则滤液中
,加入过量NaF溶液反应完全后过滤,则滤液中![]() ____________________.
____________________.
(4) “沉淀”中含杂质离子主要有![]() 、
、![]() 、_________和__________;“操作X”包括_________和_________。
、_________和__________;“操作X”包括_________和_________。
(5)某锂离子电池正极是![]() ,含
,含![]() 导电固体为电解质
导电固体为电解质![]() 充电时,
充电时,![]() 还原为Li,并以原子形式嵌入电池负极材料碳
还原为Li,并以原子形式嵌入电池负极材料碳![]() 中
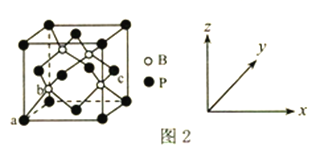
中![]() 如图2所示
如图2所示![]() 电池反应为
电池反应为![]()
![]()
![]() ,写出该电池放电时的正极反应式 ________________________________________.
,写出该电池放电时的正极反应式 ________________________________________.
【答案】 12 90 ![]()
![]() =1.5
=1.5 ![]()
![]() 洗涤 干燥
洗涤 干燥 ![]()
【解析】根据流程图,浸出时间越长浸出率越高,温度越高,浸出率越高,但浸出12h后,浸出率变化不大,90℃和120℃浸出率相差不大,且时间过长,温度过高导致成本较大,所以最佳的浸出时间为12h,最佳的浸出温度为90℃。
(2)除铁反应为非氧化还原反应,根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O +6Na2CO3 ==Na2Fe6(SO4)4(OH)12↓+5Na2SO4 +6 CO2↑,因此,本题答案为:![]()
(3)由Ksp(CaF2)=c(Ca2+)![]() c2(F-)=1.11
c2(F-)=1.11![]() 10-10,Ksp(MgF2)= c(Mg2+)
10-10,Ksp(MgF2)= c(Mg2+)![]() c2(F-)=7.40
c2(F-)=7.40![]() 10-11
10-11
![]() =
=![]() =1.5
=1.5
(4)流程中加入的Na+、![]() 、
、![]() 、NH4+ 未除去,因此 “沉淀”中含杂质离子主要有
、NH4+ 未除去,因此 “沉淀”中含杂质离子主要有![]() 、
、![]() 、
、![]() 、
、![]() ;对过滤后的沉淀进行洗涤、干燥后能得到草酸钴晶体。因此本题正确答案为:
;对过滤后的沉淀进行洗涤、干燥后能得到草酸钴晶体。因此本题正确答案为: ![]() ;
;![]() ;洗涤 ;干燥。
;洗涤 ;干燥。
(5)放电时,该电池是原电池,原电池正极发生还原反应,反应式为:CoO2+Li++e-=LiCoO2 。