��Ŀ����
����Ŀ���������ֳ��£�N2H4 �� ��ɫҺ�壩��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
��1���������ӵĵ���ʽΪ �� ���е��Ļ��ϼ�Ϊ ��
��2��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ ��
��3����2O2��g��+N2��g���TN2O4��l����H1
��N2��g��+2H2��g���TN2H4��l����H2
��O2��g��+2H2��g���T2H2O��g����H3
��2N2H4��l��+N2O4��l���T3N2��g��+4H2O��g����H4=��1048.9kJmol��1
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4= �� ������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ ��
��4������Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ƣ�������һ�����뷴Ӧ��ƽ�ⳣ��ֵΪ����֪��N2H4+H+N2H5+��K=8.7��107��Kw=1.0��10��14���������������γɵ���ʽ�εĻ�ѧʽΪ ��
��5��������һ�ֳ��õĻ�ԭ������װ������AgBr���Թ��м���������Һ���۲쵽�������� �� ���������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�������ɳ�ȥˮ���ܽ��O2kg����ʹ��Na2SO3����ˮ���ܽ��O2��ȣ��������ŵ��� ��
���𰸡�
��1��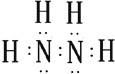 ����2
����2
��2��2NH3+NaClO�TN2H4+NaCl+H2O
��3��2��H3��2��H2����H1�������н�ǿ�Ļ�ԭ�ԣ�N2O4�н�ǿ�������ԣ�������һ�������Է���������ԭ��Ӧ
��4��8.7��10��7��N2H5HSO4
��5���Թܱڳ��ֹ���������dz��ɫת��Ϊ��ɫ����������1����������Ϊ�������Ի�������Ⱦ�����������Ʊ���������Ϊ�����ƣ������������γ���Ӱ���¯�İ�ȫʹ��
���������⣺��1���µķ���ʽΪN2H4 �� �ǵ�ԭ�Ӻ���ԭ���γ��ĸ����ۼ�����ԭ�Ӻ͵�ԭ��֮���γ�һ�����ۼ��γɵĹ��ۻ��������ʽΪ�� 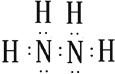 ��������Ԫ�ػ��ϼ�Ϊ+1�ۣ���Ԫ�ػ��ϼ�Ϊ��2�ۣ� ���Դ��ǣ�
��������Ԫ�ػ��ϼ�Ϊ+1�ۣ���Ԫ�ػ��ϼ�Ϊ��2�ۣ� ���Դ��ǣ� 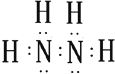 ����2����2������������������Һ���������£��������Ʊ���ԭ�����Ȼ��ƣ����ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪ��2NH3+NaClO�TN2H4+NaCl+H2O��
����2����2������������������Һ���������£��������Ʊ���ԭ�����Ȼ��ƣ����ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪ��2NH3+NaClO�TN2H4+NaCl+H2O��
���Դ��ǣ�2NH3+NaClO�TN2H4+NaCl+H2O����3����2O2��g��+N2��g���TN2O4��l����H1
��N2��g��+2H2��g���TN2H4��l����H2
��O2��g��+2H2��g���T2H2O��g����H3
�����Ȼ�ѧ����ʽ��˹���ɼ���ۡ�2���ڡ�2���ٵõ���2N2H4��l��+N2O4��l���T3N2��g��+4H2O��g����H4=2��H3��2��H2����H1 �� �����н�ǿ�Ļ�ԭ�ԣ�N2O4�н�ǿ�������ԣ�������һ�������Է���������ԭ��Ӧ�ų������ȣ�������N2O4����Ϊ����ƽ�����
���Դ��ǣ�2��H3��2��H2����H1 �� �����н�ǿ�Ļ�ԭ�ԣ�N2O4�н�ǿ�������ԣ�������һ�������Է���������ԭ��Ӧ����4������Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ƣ�������һ�����뷽��ʽΪN2H4+H2ON2H5++OH�� �� ƽ�ⳣ��Kb= 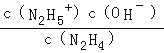 =
= 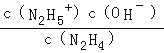 ��
�� ![]() =K��Kw=8.7��107��1.0��10��14=8.7��10��7 �� N2H4+H+N2H5+ �� �����������γɵ���ʽ��ΪN2H5HSO4 ��
=K��Kw=8.7��107��1.0��10��14=8.7��10��7 �� N2H4+H+N2H5+ �� �����������γɵ���ʽ��ΪN2H5HSO4 ��
���Դ��ǣ�8.7��10��7 �� N2H5HSO4����5�������������������������ӱ���ԭ���ɵ���������Ӧ��������Ϊ���Թܱڳ��ֹ���������dz��ɫת��Ϊ��ɫ����������
�����µ����������ǵ���������Թ�¯��ɸ�ʴ�����������Ʊ���������Ϊ�����ƣ������������γ���Ӱ���¯�İ�ȫʹ�ã�����������ʧ����N2H4��N2��4e�� �� O2��4e�� �� N2H4��O2��4e�� �� ����������Ħ����������32g/mol����������������������ʵ�����ͬ��������1kg�������ɳ�ȥˮ���ܽ��O21kg����ʹ��Na2SO3����ˮ���ܽ��O2��ȣ��������ŵ�����������Ϊ�������Ի�������Ⱦ�����������Ʊ���������Ϊ�����ƣ������������γ���Ӱ���¯�İ�ȫʹ�ã�
���Դ��ǣ��Թܱڳ��ֹ���������dz��ɫת��Ϊ��ɫ����������1����������Ϊ�������Ի�������Ⱦ�����������Ʊ���������Ϊ�����ƣ������������γ���Ӱ���¯�İ�ȫʹ�ã�



