��Ŀ����
����Ŀ����A��B��C��D��E��F��Gԭ���������ε���������Ԫ�أ����Ƕ��Ƕ����ڵ�����Ԫ�أ����У�AԪ��ԭ�ӵİ뾶��С��BԪ�ص���̬�⻯��������ۺ����������һ���Σ�Cԭ��M���������K���һ�룻Fԭ�ӵõ��������Ӻ���Arԭ�Ӻ�������Ų���ͬ��C��E��F������������ˮ���ﶼ������֮�䷢����Ӧ����ش��������⣺
��1��Fԭ�ӵ�ԭ�ӽṹʾ��ͼ�� �� GԪ���γɵĵ��ʵĽṹʽΪ ��
��2���õ���ʽ��ʾA��C�γɵĻ�������γɹ��� ��
��3��B��D��E����ԭ�ӵ�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��Żش� ��
��4�����ۻ�����FG2������ԭ�Ӷ����������8���ӹ��ͣ���д��FG2�ĵ���ʽ ��
��5��д��C��E������������ˮ����֮�䷴Ӧ�����ӷ���ʽ ��
���𰸡�
��1�� ��Cl��Cl
��Cl��Cl
��2��![]()
��3��Mg��Al��N
��4��![]()
��5��Al��OH��3+OH��=AlO2��+2H2O
���������⣺A��B��C��D��E��F��Gԭ���������ε���������Ԫ�أ����Ƕ��Ƕ����ڵ�����Ԫ�أ�AԪ��ԭ�ӵİ뾶��С����AΪHԪ�أ�BԪ�ص���̬�⻯��������ۺ����������һ���Σ���BΪNԪ�أ�Cԭ��M���������K���һ�룬��C���������Ӳ㣬ÿ��������ֱ�Ϊ2��8��1������CΪNaԪ�أ�Fԭ�ӵõ��������Ӻ���Arԭ�Ӻ�������Ų���ͬ����F�ĺ�����16�����ӣ���FΪSԪ�أ�C��E��F������������ˮ���ﶼ������֮�䷢����Ӧ����EΪAlԪ�أ�D��ԭ������С��Al����Na������DΪMgԪ�أ�G��ԭ����������S�Ķ�����Ԫ�أ�����GΪClԪ�أ�����������AΪH��BΪN��CΪNa��DΪMg��EΪAl��FΪS��GΪCl����1��FΪSԪ�أ�ԭ�Ӻ�����16�����ӣ��������Ų�����ԭ�ӽṹʾ��ͼ��  ��GΪClԪ�أ�ClԪ���γɵĵ��ʵĽṹʽΪ Cl��Cl�����Դ��ǣ�
��GΪClԪ�أ�ClԪ���γɵĵ��ʵĽṹʽΪ Cl��Cl�����Դ��ǣ�  ��Cl��Cl����2��A��C�γɵĻ�����ΪNaHS���õ���ʽ��ʾNaHS���γɹ���Ϊ��
��Cl��Cl����2��A��C�γɵĻ�����ΪNaHS���õ���ʽ��ʾNaHS���γɹ���Ϊ�� ![]() ��
��
���Դ��ǣ� ![]() ����3�����Ӳ�Խ��ԭ�Ӱ뾶Խ���Ӳ���ͬ��ԭ�ӣ�ԭ������Խ�뾶ԽС������ԭ�Ӱ뾶��Mg��Al��N��
����3�����Ӳ�Խ��ԭ�Ӱ뾶Խ���Ӳ���ͬ��ԭ�ӣ�ԭ������Խ�뾶ԽС������ԭ�Ӱ뾶��Mg��Al��N��
���Դ��ǣ�Mg��Al��N����4�����ۻ�����SCl2������ԭ�Ӷ����������8���ӹ��ͣ���SCl2�ĵ���ʽΪ ![]() ��
��
���Դ��ǣ� ![]() ����5��CΪNa��EΪAl��Na��Al������������ˮ����֮�䷴Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
����5��CΪNa��EΪAl��Na��Al������������ˮ����֮�䷴Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
���Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O��

����Ŀ���ش���������
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϣ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų���ͼ1��ʾ����ͬѧ�����ĵ����Ų�ͼΥ�� �� BԪ��λ�����ڱ���������е���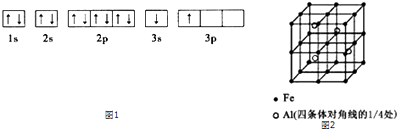
��ACl2������A���ӻ�����Ϊ �� ACl2�Ŀռ乹��Ϊ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ ��
��д��һ����CN����Ϊ�ȵ�����ĵ��ʵĵ���ʽ ��
���������������[Fe��CN��6]4������� ��
A�����ۼ� B���Ǽ��Լ� C����λ�� D���Ҽ� E���м�
��3��һ��Al��Fe�Ͻ�����徧����ͼ2��ʾ����ݴ˻ش��������⣺
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶ�=�� g/cm3 �� ��˺Ͻ������������Feԭ��֮��ľ��루�ú��ѵĴ���ʽ��ʾ�����ػ���Ϊcm��