题目内容
【题目】W,X,Z是原子序数依次增大的同一短周期元素,W,X是金属元素,Z是非金属元素,W,X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( ) 
A.d点对应的溶液中:K+、NH4+、C032﹣、I﹣
B.c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D.a点对应的溶液中:Na+、K+、S042﹣、HCO3﹣
【答案】C
【解析】解:W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,则W为Na元素,X为Al元素;X与Z形成XZ3溶液,则Z为Cl元素.向一定量的NaOH溶液中逐滴加入AlCl3溶液.
由图可知,0~b,没有沉淀,故溶液中氢氧化钠有剩余,溶液中溶质为氢氧化钠、偏铝酸钠、氯化钠.
b点时,氢氧化钠与氯化铝恰好完全反应,溶液中溶质为偏铝酸钠、氯化钠
b~c,沉淀增大,偏铝酸根与铝离子发生双水解反应,生成氢氧化铝沉淀,溶液中溶质为偏铝酸钠、氯化钠.
c点时,沉淀达最大,偏铝酸根与铝离子恰好完全反应,溶液中溶质为氯化钠.
c点以后,再加入氯化铝,沉淀不变,溶液中溶质为氯化铝、氯化钠.
A、d点对应的溶液中含有Al3+ , Al3+与C032﹣发生水解反应生成氢氧化铝沉淀、二氧化碳,不能大量共存,故A;
B、c点对应的溶液中含有Cl﹣ , Cl﹣与Ag+反应生成氯化银沉淀,不能大量共存,故B错误;
C、b点对应的溶液中偏铝酸钠、氯化钠,离子之间不发生反应,可以大量共存,故C正确;
D、a点对应的溶液中含有氢氧化钠、偏铝酸钠、氯化钠,OH﹣与HCO3﹣发生反应生成碳酸根与水,不能大量共存,故D错误.
故选:C.
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,则W为Na元素,X为Al元素;X与Z形成XZ3溶液,则Z为Cl元素.向一定量的NaOH溶液中逐滴加入AlCl3溶液.
由图可知,0~b,没有沉淀,故溶液中氢氧化钠有剩余,溶液中溶质为氢氧化钠、偏铝酸钠、氯化钠.
b点时,氢氧化钠与氯化铝恰好完全反应,溶液中溶质为偏铝酸钠、氯化钠
b~c,沉淀增大,偏铝酸根与铝离子发生双水解反应,生成氢氧化铝沉淀,溶液中溶质为偏铝酸钠、氯化钠.
c点时,沉淀达最大,偏铝酸根与铝离子恰好完全反应,溶液中溶质为氯化钠.
c点以后,再加入氯化铝,沉淀不变,溶液中溶质为氯化铝、氯化钠.
结合物质性质判断.

【题目】回答下列问题
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背 , B元素位于周期表五个区域中的区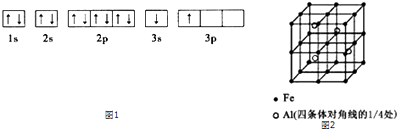
②ACl2分子中A的杂化类型为 , ACl2的空间构型为 .
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为 .
②写出一种与CN﹣互为等电子体的单质的电子式 .
③六氰合亚铁离子[Fe(CN)6]4﹣中不存在 .
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al﹣Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式 .
②若晶体的密度=ρ g/cm3 , 则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为cm.