题目内容
下列实验方案设计中,可行的是
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
B
解析试题分析:A、汽油和煤油相互溶解,萃取是对溶解度有很大差异的,错误;B、铜不溶于盐酸,镁可以溶于盐酸,正确;C、硝酸钾和氯化钠都溶于水,不能用溶解和过滤的方法分离,错误;D、氢气和氧化铜反应生成有水蒸气,又带来新的杂质,错误。
考点:考查基本实验操作

 华东师大版一课一练系列答案
华东师大版一课一练系列答案亚铁盐中,FeSO4?7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4?FeSO4?6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
实验室用废铁屑制备莫尔盐的过程如下:
(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 | 若 ,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
下列有关实验操作,现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量CO2通入CaCl2溶液中 | 无白色沉淀 | 生成Ca(HCO3)2溶于水 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
关于图中各装置的叙述不正确的是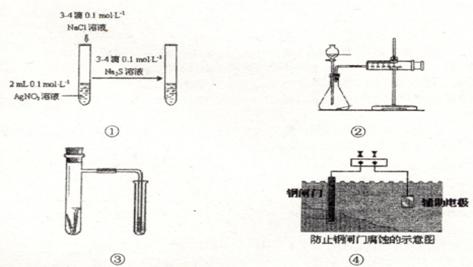
| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②能测量锌与硫酸的反应速率 |
| C.装置③能验证铁的吸氧腐蚀 |
| D.装置④的X电极是负极,则能验证外接电源的阴极保护法 |
仅用下表提供的仪器和药品,就能达到相应实验目的的是、
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量份数的NaCl溶液 |
| B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、碳酸钠溶液 | 证明非金属性:Cl>C>Si |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液,NaoH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
用下图所示装置进行实验,不能达到实验目的的是:( )
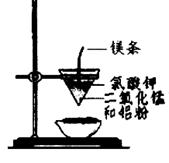
甲 乙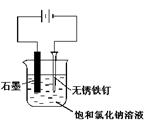
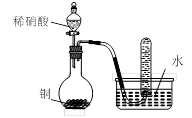
丙 丁
| A.用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B.用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C.用丙装置可实现对铁钉的保护 |
| D.用丁装置验证铜与稀硝酸反应的气体产物只有NO |
如图带漏斗U型管中装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面a附近上下往复运动,下列说法不正确的是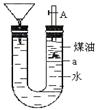
| A.此碱金属可能是钾或钠 |
| B.反应一段时间煤油会燃烧 |
| C.碱金属上下运动是由于与水反应产生了氢气 |
| D.若是金属锂则不能观察到上述现象 |
下述实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积的盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉 |
