题目内容
亚铁盐中,FeSO4?7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4?FeSO4?6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
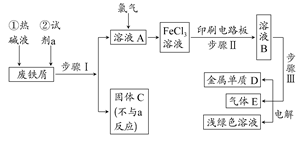
实验室用废铁屑制备莫尔盐的过程如下:
(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 | 若 ,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
(16分)
(1)加入足量稀硫酸(或稀盐酸),充分搅拌 (2分)
(2)酒精灯、温度计 (4分,每空2分)
(3)1∶1 B (4分,每空2分)
(4)(6分,每空2分)序号 实验方案 实验现象和结论 步骤1 取少量样品 露置空气一段时间(1分) 样品颜色可能有变化。 步骤2 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,_加入1~2滴KSCN溶液(2分)__ 若溶液变成血红色(2分),说明样品中含有FeSO4·7H2O杂质。 步骤3 若步骤2证明样品不含FeSO4 ·7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 若w1 >(或大于)(1分)w2,说明样品中含有(NH4)2SO4杂质。
解析试题分析:(1)废铁屑含有单质铁和铁锈,铁锈主要成分是氧化铁,氧化铁是碱性氧化物,易溶于强酸,生成盐和水,因此步骤I除锈的操作是:将废铁屑放入烧杯,加入足量稀硫酸(或稀盐酸),充分搅拌,过滤,洗涤;(2)水浴加热装置需要的仪器是铁架台、石棉网、大烧杯、酒精灯、温度计;(3)步骤III的原理为FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O,该反应中n[(NH4)2SO4]∶n[FeSO4]=1∶1;A项,称取废铁屑的质量,不能推断硫酸铵的量,因此废铁屑中铁锈与单质铁的组成比例未知,过量的无锈铁屑的量未知,不能确定硫酸亚铁的量,故A选项错误;B项,称量无锈铁屑和步骤II之后剩余铁屑的质量,可以计算出与稀硫酸反应时消耗单质铁的量,根据硫酸亚铁与消耗单质铁的系数之比可以求生成的硫酸亚铁的量,进而推算所需(NH4)2SO4的质量,故B选项正确;C项,测定FeSO4溶液的浓度和体积,可以求硫酸亚铁的量,进而推算所需(NH4)2SO4的质量,但是需要进行滴定实验,配制标准酸性高锰酸钾溶液,因此不简便可行,故C选项错误;(4)硫酸铵是白色固体,七水合硫酸亚铁(或绿矾)是绿色固体,在空气中露置时,前者不易变质,而后者则容易被空气中的氧气氧化为铁盐,铁盐固体为黄色,因此样品露置之后颜色可能有变化;硫酸铁、硫酸亚铁都易溶于水,步骤1所得固体用去氧蒸馏水溶解,目的是防止蒸馏水中溶解的氧气氧化亚铁离子,调节至酸性后,加入KSCN溶液,溶液变为血红色,说明存在铁离子,证明样品中含有含有FeSO4·7H2O杂质;摩尔盐或(NH4)2SO4?FeSO4?6H2O中NH4+的质量分数计算表达式为: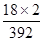 ×100%=9.18%,而(NH4)2SO4中NH4+的质量分数计算表达式为:w2=
×100%=9.18%,而(NH4)2SO4中NH4+的质量分数计算表达式为:w2=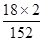 ×100%=23.68%,因此理论值w2=9.18%,若含有(NH4)2SO4时,w1介于二者9.18%与23.68%之间,所以w1> w2时,说明摩尔盐中含有硫酸铵杂质。
×100%=23.68%,因此理论值w2=9.18%,若含有(NH4)2SO4时,w1介于二者9.18%与23.68%之间,所以w1> w2时,说明摩尔盐中含有硫酸铵杂质。
考点:考查化学实验方案的设计与评价,涉及除去废铁屑中铁锈的实验操作、水浴加热装置所用仪器、物质的量在化学方程式计算中的应用、实验方案的评价、摩尔盐中杂质成分探究实验方案的设计、包括亚铁离子的氧化、铁离子的显色反应、铵根离子质量分数测定理论值与实际值大小关系等。

实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
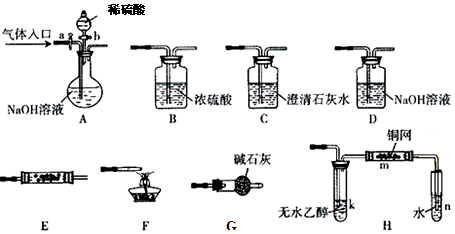
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: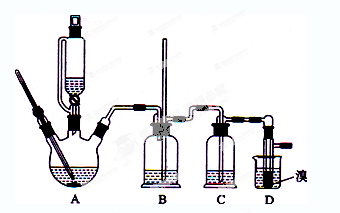
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
下列实验方案设计中,可行的是
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
下列各实验装置图的叙述中,正确的是( )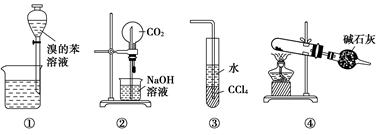
| A.装置①为放出萃取溴水后的苯层 |
| B.装置②为喷泉实验 |
| C.装置③可用来吸收HCl气体 |
| D.以NH4Cl为原料,装置④可用于制备少量NH3 |