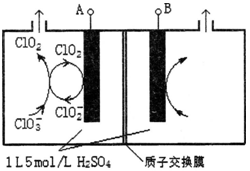
题目内容
(12分)我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下: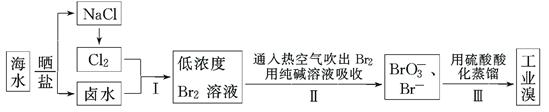
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
(12分,每空2分)⑴富集溴元素
⑵C
⑶3 3 1 5 3
⑷SO2 +Br2+2H2O=4H+ +2Br -+SO42- 强酸对设备的严重腐蚀
⑸BD
解析试题分析:(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,目的是富集溴元素,尽可能提取海水中的溴;
(2)溴易挥发,所以用通入热空气或水蒸气的方法吹出Br2,答案选C。
(3)该反应中,反应物中的Br元素的化合价是0,生成物中的BrO的化合价是+5价,Br-的化合价是-1价,根据得失电子守恒的原则,BrO的系数是1,Br-的系数是5,所以Br2的系数是3,根据电荷守恒,CO的系数是3,CO2的系数是3;
(4)溴与二氧化硫发生氧化还原反应生成溴化氢和硫酸,离子方程式为SO2 +Br2+2H2O=4H+ +2Br -+SO42- ;由于反应中生成了2种强酸,对设备的腐蚀性较强,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀;
(5)可以用作溴的萃取剂应满足溴在该溶剂中的溶解度大于在水中的溶解度,且水与该溶剂是互不相溶的,A、乙醇与水互溶,错误;B、四氯化碳与水不互溶,且溴易溶于四氯化碳,符合萃取剂的选择,正确;C、裂化汽油中含有不饱和键,与溴发生加成反应,错误;D、苯与水不互溶且溴易溶于苯,正确,答案选BD。
考点:考查对工业流程的分析,物质的性质,方程式的配平,萃取剂的选择

下列表示对应化学反应的离子方程式错误的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O |
| B.向甲酸溶液中加入KOH溶液:HCOOH+OH-=HCOO-+H2O |
| C.将过量CO2通入冷氨水中:CO2+NH3?H2O=HCO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
下列化学反应的离子方程式正确的是( )
| A.在稀氨水中通入过量CO2:NH3·H2O + CO2 = NH4+ + HCO3- |
| B.少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ +2ClO— = CaSO3↓+2HClO |
| C.用稀盐酸与大理石反应:2H+ + CO32— = H2O + CO2↑ |
| D.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2+ +OH— +H+ + SO42- = BaSO4↓+H2O |
某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )
| A.Al3+、NO3―、K+、SO42ˉ | B.Ca2+、H+、CO32ˉ、AlO2― |
| C.OHˉ、SO42ˉ、NH4+、Al3+ | D.Fe3+、Mg2+、NO3ˉ、Clˉ |
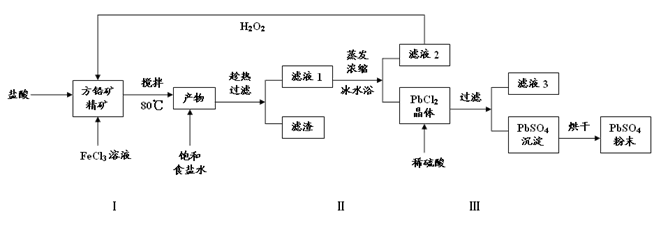
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为 。
 PbCl4-(aq) △H>0
PbCl4-(aq) △H>0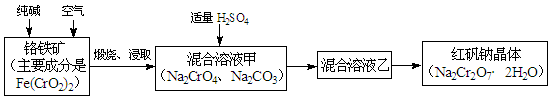
 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。