题目内容
下列化学反应的离子方程式正确的是( )
| A.在稀氨水中通入过量CO2:NH3·H2O + CO2 = NH4+ + HCO3- |
| B.少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ +2ClO— = CaSO3↓+2HClO |
| C.用稀盐酸与大理石反应:2H+ + CO32— = H2O + CO2↑ |
| D.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2+ +OH— +H+ + SO42- = BaSO4↓+H2O |
A
解析试题分析:A中反应CO2过量,所以选项A正确;B中SO2具有还原性,次氯酸钙具有氧化性,二者发生反应生成硫酸钙,B不正确;大理石是难溶性物质,应该用化学式表示,C不正确;D中没有配平,应该是Ba2+ +2OH— +2H+ + SO42- = BaSO4↓+2H2O,D不正确,答案选A。
考点:考查离子方程式的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。

下列离子方程式表达正确的是( )
| A.向氯化铁溶液中滴加HI溶液:2Fe3++ 2HI = 2Fe2++2H++I2 |
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH—+Al3++2SO42-=2BaSO4↓+AlO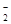 +2H2O +2H2O |
| C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+ = Al(OH)3↓+Al3++H2O |
| D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-- |
在溶液中能大量共存的一组离子或分子是
| A.K+ 、Al3+、SO42—、NH3·H2O | B.NH4+、H+、NO3—、HCO3— |
C.Na+ 、CH3COO—、CO32—、OH— | D.Na+、K+、SO32—、Cl2 |
下列有关说法正确的是( )
| A.一个SiO2分子中含有2个Si—O键,一个C2H4中含5对共用电子 |
| B.给铁皮镀锌可以有效的防止铁的电化学腐蚀 |
| C.金属氧化物和硝酸反应都只生成盐和水 |
| D.在强电解质水溶液中电解质全都以自由移动的离子形式存在 |
钠与水反应的离子方程式正确的是( )
| A.2Na+3H+=2Na++H2↑ |
| B.Na+H2O=Na++OH-+H2↑ |
| C.2Na+2H2O=2Na++2OH-+H2↑ |
| D.2Na+2H2O=2Na++O2↑+2H2↑ |
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
| A.Na2CO3和HCl | B.NaHCO3和Ba(OH)2 | C.NaAlO2和H2SO4 | D.AgNO3和NH3·H2O |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-  NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
【化学——选修2:化学与技术】(15分)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: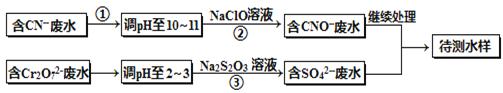
(1)上述处理废水流程中主要使用的方法是_________________;
(2)②中反应后无气体放出,该反应的离子方程式为______________;
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应的离子方程式为 ;
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 ;
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于: (铁氧磁体,罗马数字表示元素价态)的沉淀。
(铁氧磁体,罗马数字表示元素价态)的沉淀。
处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a ="8" | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |