题目内容
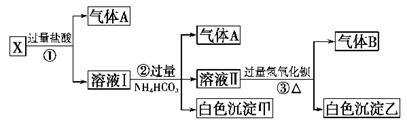
(6分)某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中①肯定含有_______,②不能确定是否含有 _________,③一定不含有_______。
Na2CO3;KNO3、KCl、NaCl;K2SO4、KI、CuCl2、CaCl2
解析试题分析:混合物加水得无色透明溶液,则一定没有氯化铜;向上述溶液中滴加BaCl2溶液,有白色沉淀生成则硫酸钾和碳酸钠至少含有一种;上述白色沉淀可完全溶于稀盐酸,说明白色沉淀是碳酸钡,因此没有硫酸钾,含有碳酸钠,则一定没有氯化钙;将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色,说明没有单质碘生成,所以原混合物中没有碘化钾;将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,则白色沉淀是氯化银,但由于引入了氯化钡溶液,所以不能确定是否含有氯化钾或氯化钠,同样硝酸钾也不能确定,故原混合物中肯定含有碳酸钠,不能确定是否含有硝酸钾、氯化钾和氯化钠,一定不含有碘化钾、硫酸钾、氯化铜和氯化钙。
考点:考查离子共存和离子检验的有关判断

 阅读快车系列答案
阅读快车系列答案下列离子方程式正确的是
| A.氢氧化镁与稀盐酸反应:H+ + OH-=H2O |
| B.AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
钠与水反应的离子方程式正确的是( )
| A.2Na+3H+=2Na++H2↑ |
| B.Na+H2O=Na++OH-+H2↑ |
| C.2Na+2H2O=2Na++2OH-+H2↑ |
| D.2Na+2H2O=2Na++O2↑+2H2↑ |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-  NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
下列离子方程式书写正确的是
| A.硫氢化钠的水解:HS-+H2O === S2-+H3O+ |
| B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=== Fe3++3H2O |
| C.钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O === 4OH- |
| D.碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-=== CO32-+H2O |

 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时: